题目内容
【题目】完成下列探究实验.
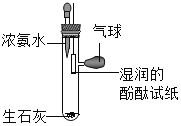
(1)小然同学设计探究分子运动的实验如图1,请按要求完成下列各小题:
①滴入适量浓氨水后,观察到酚酞试纸__________,原因是____.
②放入少量生石灰的作用是____,试写出发生的化学反应方程式____.
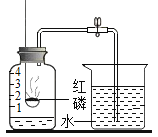
(2)有一袋白色粉末,甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学认为是碳酸钠和碳酸氢钠的混合物.为了探究该白色粉末的成分,进行了以下实验:
①将少量白色粉末放入水中搅拌,观察到____,说明甲同学的猜想不正确.
②室温时,分别向盛有等质量的碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸,记录如下表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
Ⅰ | 碳酸氢钠 | 0.10 | V1 |
Ⅱ | 碳酸钠 | 0.10 | V2 |
Ⅲ | 白色粉末 | 0.10 | V3 |
(解释与结论)
③实验I的化学方程式为_____;
④表中V1___V2(填“>”、“<”或“=”);
⑤若V1>V3>V2则白色粉末物质为_____
【答案】变红色 氨分子不断运动,遇到湿润的酚酞试纸生成氨水显碱性,酚酞遇碱性物质变红 加快氨分子的运动速率 CaO+H2O═Ca(OH)2 固体全部溶解 NaHCO3+HCl=NaCl+H2O+CO2↑ > 碳酸钠和碳酸氢钠
【解析】
(1)①滴入适量浓氨水后,观察到酚酞试纸;原因是:氨分子不断运动,遇到湿润的酚酞试纸生成氨水显碱性,酚酞遇碱性物质变红;
②放入少量生石灰的作用是加快氨分子的运动速率,因为生石灰遇水放热,试管内温度升高,氨分子的运动速率加快;生石灰遇水放热反应原理:CaO+H2O═Ca(OH)2;
(2)①将少量白色粉末放入水中搅拌,固体物质全部溶解,说明甲同学的猜想不正确,因为碳酸钙不溶于水;
③碳酸氢钠与盐酸反应原理:NaHCO3+HCl=NaCl+H2O+CO2↑;
④等质量的碳酸氢钠和碳酸钠与足量的盐酸反应产生二氧化碳气体质量较大的是碳酸氢钠,
设碳酸氢钠和碳酸钠质量为m,对应产生二氧化碳的质量分别为x和y。
则对应关系如下
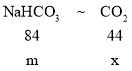
![]() =
=![]() x=
x=![]()
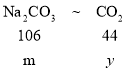
![]() =
=![]() y=
y=![]()
x>y,则碳酸氢钠产生的气体质量大于碳酸钠产生的气体质量,二氧化碳密度相等,则碳酸钠产生的气体体积大于碳酸钠产生的气体体积,V1>V2;
④若V1>V3>V2,白色样品产生的二氧化碳气体大于碳酸钠产生气体,小于碳酸氢钠产生的气体,则说明白色样品中是碳酸钠和碳酸氢钠的混合固体

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案