题目内容
【题目】学习了氧气的性质后,我们对氧气有了进一步的了解,读如图回答下列问题。

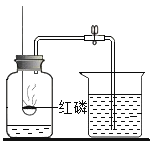
(1)硫燃烧时发生的反应的文字表达式是___________________。
(2)以上三个实验说明氧气具有的化学性质是 ____________,同时说明可燃物燃烧的剧烈程度和氧气的浓度有关。
(3)铁丝在氧气中燃烧时需将铁丝绕在火柴杆上,那么火柴杆的作用是 __________。
(4)铁丝燃烧时,集气瓶中发生的反应的文字表达式是________________,集气瓶中少量水的作用是 _________________。
【答案】硫+氧气![]() 二氧化硫 助燃性 铁+氧气
二氧化硫 助燃性 铁+氧气![]() 四氧化三铁 利用火柴燃烧提高铁丝的温度,达到了铁的着火点 防止高温熔融物掉落瓶底导致集气瓶炸裂
四氧化三铁 利用火柴燃烧提高铁丝的温度,达到了铁的着火点 防止高温熔融物掉落瓶底导致集气瓶炸裂
【解析】
(1)硫在空气中点燃生成二氧化硫,反应的文字表达式为:硫+氧气![]() 二氧化硫
二氧化硫
(2)三个实验说明氧气具有助燃性。
(3)铁丝在氧气中燃烧时需将铁丝绕在火柴杆上,利用火柴燃烧提高铁丝的温度,当温度达到了铁的着火点时,插入氧气中后,铁丝燃烧。
(4)铁在氧气中点燃生成四氧化三铁,反应的方程式为:铁+氧气![]() 四氧化三铁;为了防止高温熔融物掉落瓶底导致集气瓶炸裂,故要在瓶底放少许沙子或水。
四氧化三铁;为了防止高温熔融物掉落瓶底导致集气瓶炸裂,故要在瓶底放少许沙子或水。

【题目】铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
【题目】某化学兴趣小组在做“铁在氧气中燃烧”的实验时,进行了一系列探究活动,请你一同参与。
(探究一)铁丝燃烧是否需要纯氧
(实验内容)取长短相同,直径均为0. 38 mm的铁丝,分别在体积分数为90%,70%,60%,55%的O2中实验。
(实验现象)
氧气含量 | 90% | 70% | 60% | 55% |
实验现象 | 燃烧剧烈、燃烧 时间长,效果好 | 燃烧比90%弱, 燃烧时间短,实 验成功 | 燃烧比70%弱, 燃烧时间更短, 实验成功 | 难以燃烧,只是发红 |
(1)铁丝在氧气中燃烧的表达式为:_________________________________
(2)实验中所用的不同体积分数的氧气可用____________收集(填“向上排空气法”或“排水法”)。
(3)若用如图装置收集一瓶(150 mL)含氧气的体积分数约为60%的气体,方法是在150 mL集气瓶里装满水,塞紧橡胶塞并关闭活塞b,打开活塞a通入氧气,把瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把瓶里的水全部排入量筒,则停止通入氧气时量筒内水的体积约为__________(提示:空气中氧气的体积分数约为![]() )。
)。
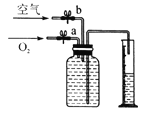
A25 mL B40 mL C60 mL D75 mL
(结论)就0. 38 mm铁丝而言,燃烧所需氧气的最低体积分数为___________,且氧气浓度越大,燃烧越_________(填“剧烈”或“不剧烈”)。
(拓展)小明指出上述关于铁丝燃烧所需氧气最低浓度的结论不合理,理由是_________________。
(探究二)铁丝燃烧产生火星四射的原因
(查阅资料)
①日常生活中的钢铁制品都含有少量碳杂质;
②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
(实验内容)取长短相同、直径均为0. 20 mm、含碳量不同的铁丝分别在足量的氧气中燃烧,观察现象。
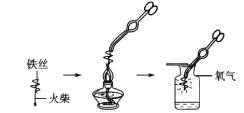
(1)小明按上图实验时,集气瓶中放水的目的是__________________。
(2)下表是他将几种铁丝放入氧气中燃烧时的实验现象的记录。请你分析完成下表:
物质 | 纯铁丝 | 含碳0.05 %的铁丝 | 含碳0.2 %的铁丝 | 含碳0.6 %的铁丝 |
燃烧时的现象 | 无火星四射现象,熔断 | 剧烈燃烧极少火星 | 剧烈燃烧少量火星 | __________________ |
(3)通过以上实验,说明铁丝燃烧产生火星四射现象和______________(填元素符号)有关
【题目】完成下列探究实验.
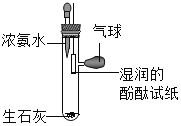
(1)小然同学设计探究分子运动的实验如图1,请按要求完成下列各小题:
①滴入适量浓氨水后,观察到酚酞试纸__________,原因是____.
②放入少量生石灰的作用是____,试写出发生的化学反应方程式____.
(2)有一袋白色粉末,甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学认为是碳酸钠和碳酸氢钠的混合物.为了探究该白色粉末的成分,进行了以下实验:
①将少量白色粉末放入水中搅拌,观察到____,说明甲同学的猜想不正确.
②室温时,分别向盛有等质量的碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸,记录如下表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
Ⅰ | 碳酸氢钠 | 0.10 | V1 |
Ⅱ | 碳酸钠 | 0.10 | V2 |
Ⅲ | 白色粉末 | 0.10 | V3 |
(解释与结论)
③实验I的化学方程式为_____;
④表中V1___V2(填“>”、“<”或“=”);
⑤若V1>V3>V2则白色粉末物质为_____