题目内容
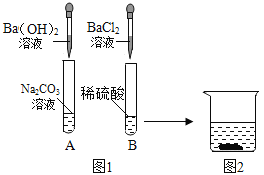
【题目】为了探究物质的化学性质,某兴趣小组做了如图1所示实验。实验结束后,小组同学将A、B两支试管中的上层清液倒进一洁净的烧杯中,观察到一会儿后才有气泡产生,然后有白色沉淀生成(如图2)。
请回答下列问题:
(1)Na2CO3溶液呈_____性。
(2)B试管中出现的现象是_____。
(3)A试管中的物质充分反应后,所得溶液的溶质有_____。
(4)写出烧杯中有气泡产生的反应的化学方程式_____。
(5)小组同学将烧杯内的物质进行过滤。为了确定滤液中溶质的成分,小组同学进行了如下探究。
(作出猜想)猜想Ⅰ:NaCl
猜想Ⅱ:NaCl、NaOH
猜想Ⅲ:NaCl、BaCl2
(评价交流)你认为以上猜想_____不合理,理由是_____。则你的猜想为_____。
(实验验证)小组同学取少量滤液于试管中,只加入一种溶液,就确定了滤液的溶质成分,加入的溶液是_____。
(总结归纳)可溶性物质反应后,所得溶液中溶质的组成最简单的情况是:反应物_____。
【答案】碱 生成白色沉淀 Na2CO3、NaOH Na2CO3+2HCl=2NaCl+CO2↑+H2O Ⅱ HCl与Na2CO3反应生成气体之前会先与NaOH反应 NaCl、Na2CO3 稀硫酸 恰好完全反应
【解析】
根据氢氧化钠和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,将A、B两支试管中的上层清液倒进一洁净的烧杯中,观察到一会儿后才有气泡产生,然后有白色沉淀生成,所以反应结束,试管A中含有碳酸钠、氢氧化钠,试管B中含有氯化钡、稀盐酸进行分析。
解:氢氧化钠和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,将A、B两支试管中的上层清液倒进一洁净的烧杯中,观察到一会儿后才有气泡产生,然后有白色沉淀生成,所以反应结束,试管A中含有碳酸钠、氢氧化钠,试管B中含有氯化钡、稀盐酸,所以:
(1)Na2CO3溶液呈碱性;
(2)B试管中出现的现象是:生成白色沉淀;
(3)A试管中的物质充分反应后,所得溶液的溶质有Na2CO3、NaOH;
(4)烧杯中有气泡产生的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(5)[评价交流]碳酸钠、氢氧化钠的混合溶液中加入稀盐酸,稀盐酸会先与碳酸钠反应,所以以上猜想II不合理,理由是:HCl与Na2CO3反应生成气体之前会先与NaOH反应;
我的猜想为:NaCl、Na2CO3;
[实验验证]小组同学取少量滤液于试管中,只加入一种溶液,稀硫酸会与氯化钡反应生成硫酸钡沉淀,会与碳酸钠反应生成二氧化碳气体,和氢氧化钠没有明显现象,确定滤液的溶质成分加入的溶液是:稀硫酸;
[总结归纳]可溶性物质反应后,所得溶液中溶质的组成最简单的情况是:反应物恰好完全反应。

 巧学巧练系列答案
巧学巧练系列答案【题目】某同学对下表中的溶解度数据分析后,得出的结论正确的是( )
温度/℃ | 0 | 20 | 40 | 60 |
KCl的溶解度/g | 27.6 | 34.0 | 40.0 | 45.5 |
KNO3的溶解度/g | 13.3 | 31.6 | 63.9 | 110 |
Ca(OH)2的溶解度/g | 0.18 | 0.16 | 0.14 | 0.11 |
A.硝酸钾的溶解度最大
B.降温可将不饱和的Ca(OH)2溶液变为饱和溶液
C.40℃时,饱和的氯化钾溶液溶质质量分数为40%
D.当KNO3中混有少量KCl时,可以用冷却热饱和溶液的方法提纯
【题目】铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
【题目】完成下列探究实验.
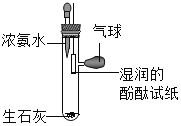
(1)小然同学设计探究分子运动的实验如图1,请按要求完成下列各小题:
①滴入适量浓氨水后,观察到酚酞试纸__________,原因是____.
②放入少量生石灰的作用是____,试写出发生的化学反应方程式____.
(2)有一袋白色粉末,甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学认为是碳酸钠和碳酸氢钠的混合物.为了探究该白色粉末的成分,进行了以下实验:
①将少量白色粉末放入水中搅拌,观察到____,说明甲同学的猜想不正确.
②室温时,分别向盛有等质量的碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸,记录如下表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
Ⅰ | 碳酸氢钠 | 0.10 | V1 |
Ⅱ | 碳酸钠 | 0.10 | V2 |
Ⅲ | 白色粉末 | 0.10 | V3 |
(解释与结论)
③实验I的化学方程式为_____;
④表中V1___V2(填“>”、“<”或“=”);
⑤若V1>V3>V2则白色粉末物质为_____