题目内容
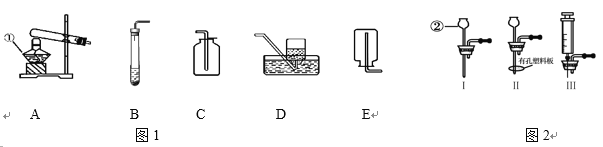
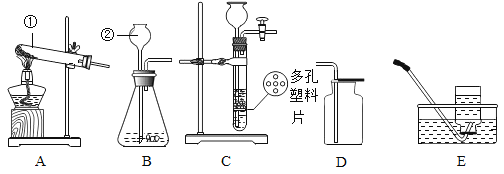
【题目】下列是实验室制取氧气和氧气性质实验常用的装置,请回答下列问题。
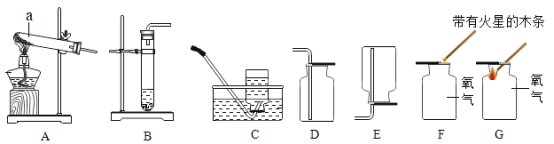
(1)装置图中标号a仪器的名称是_____________。
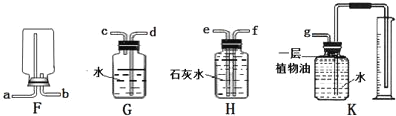
(2)若选择A装置制取氧气,发生反应的文字表达式为_____________,收集一瓶干燥的氧气应选择装置____________(填字母序号),检验氧气是否收集满的正确操作是______(选填“F”或“G”);若选择B装置制取氧气,所用的药品是____________。
(3)若用高锰酸钾制取并收集氧气,应选择的装置是________(填字母序号),该装置还需要进行改进的是________________,小明在实验过程中发现试管裂,请你帮他分析可能的原因是__________(答一点即可)。
(4)某化学兴趣小组通过实验探究分解氯酸钾制氧气的反应中二氧化锰的作用。
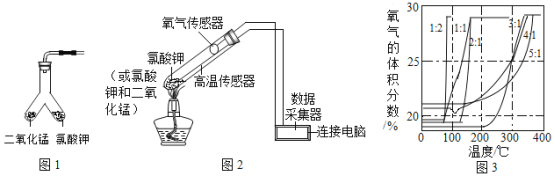
(设计实验)用图 1 所示装置进行实验,步骤如下:
步骤Ⅰ:检查装置气密性;
步骤Ⅱ:按照如图 1 装入药品;
步骤Ⅲ:加热右侧支管,用带火星的木条在导管口检验生成的气体;
步骤Ⅳ:冷却后,将装置倾斜,使左侧支管中的药品进入右侧支管,再加热右侧支管,用带火星的木条在导管口检验生成的气体。
(实验现象)步骤Ⅲ和步骤Ⅳ中,一段时间后都能观察到带火星的木条复燃,但不同的是_________。
(交流反思)要想确认分解氯酸钾制氧气的反应中二氧化锰是催化剂,还需通过实验证明二氧化锰的__________________________在反应前后都没有发生变化.
(拓展探究)在老师的指导下,该小组同学利用图 2所示装置继续进行深入探究。以氧气的体积分数为纵坐标,温度为横坐标,得到图 3所示曲线(图中的“1:2”、“1:1”、“2:1”、“3:1”、“4:1”、“5:1”指氯酸钾和二氧化锰的质量比)
(实验分析)根据图3,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是__________。分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能________。
【答案】试管 氯酸钾![]() 氯化钾+氧气 D F 过氧化氢溶液和二氧化锰固体 AC或AD 试管口要放一团棉花 没有预热或试管外壁有水或试管口没有略向下倾斜等 步骤Ⅳ中木条复燃更快 质量和化学性质 氯酸钾和二氧化锰质量比越小,氯酸钾分解温度越低 降低氯酸钾的分解温度
氯化钾+氧气 D F 过氧化氢溶液和二氧化锰固体 AC或AD 试管口要放一团棉花 没有预热或试管外壁有水或试管口没有略向下倾斜等 步骤Ⅳ中木条复燃更快 质量和化学性质 氯酸钾和二氧化锰质量比越小,氯酸钾分解温度越低 降低氯酸钾的分解温度
【解析】
(1)装置图中标号a仪器的名称是试管;
(2)A装置属于固体加热型,试管口没有放一团棉花,是采用加热氯酸钾和二氧化锰混合物制氧气的方法,氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,反应的文字表达式为氯酸钾![]() 氯化钾+氧气;氧气密度比空气大,向上排空气法收集的氧气干燥,所以要收集一瓶干燥的氧气,应选择的收集装置是D,氧气有助燃性,所以检验氧气是否集满的方法是:把带火星的木条放在集气瓶口,木条复燃,证明集满,故选F;若选择B装置制取氧气,是用固体和液体制取氧气,所用的药品是过氧化氢溶液和二氧化锰固体;
氯化钾+氧气;氧气密度比空气大,向上排空气法收集的氧气干燥,所以要收集一瓶干燥的氧气,应选择的收集装置是D,氧气有助燃性,所以检验氧气是否集满的方法是:把带火星的木条放在集气瓶口,木条复燃,证明集满,故选F;若选择B装置制取氧气,是用固体和液体制取氧气,所用的药品是过氧化氢溶液和二氧化锰固体;
(3)高锰酸钾制取氧气的反应物是固体,反应条件是加热,可选用的发生装置A;氧气的密度大于空气,不易溶于水,可用向上排空气法或排水法收集,收集装置选用C或D;若用高锰酸钾制取并收集氧气,应选择的装置是AC或AD,为防止高锰酸钾进入导管,该装置还需要进行改进的是试管口要放一团棉花,小明在实验过程中发现试管裂,可能的原因是没有预热;试管外壁有水;试管口没有略向下倾斜等;
(4)实验现象:
步骤Ⅲ中是单独加热氯酸钾制取氧气,需要加热的温度较高,加热时间长,所以带火星的木条复燃较慢;步骤Ⅳ中氯酸钾在二氧化锰的催化作用下分解生成氧气,需要的温度较低,分解速率快,所以带火星的木条复燃较快;
交流反思:
在化学反应里能改变其他物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质叫做催化剂,所以步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,还需证明在此反应中MnO2的质量和化学性质不变;
实验
通过分析图3中氯酸钾的分解数据可知,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是氯酸钾和二氧化锰的质量比越小,氯酸钾的分解温度越低;分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能降低氯酸钾的分解温度。

【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,引起了化学探究小组的兴趣。
(提出问题)
氧化铜能否作过氧化氢溶液分解的催化剂?
(实验探究)
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL 5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铜粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条 复燃,B试管中无明显现象。 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木 条均复燃。 |
Ⅲ.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
(实验结论)
(1)由实验Ⅰ你可以得出的结论是__________能加快过氧化氢分解生成氧气的速率。
(2)实验Ⅱ、Ⅲ证明:氧化铜的___________和__________在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)过氧化氢在氧化铜的催化下分解放出氧气反应的文字表达式为_______。
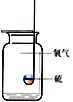
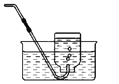
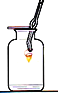
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是 ( )
实 验 装 置 |
硫在氧气中燃烧 |
排水法收集氧气 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
解释 | 集气瓶中的水: 吸收放出的热量 | 集气瓶中的水: 水将集气瓶内的空气排干净,便于观察氧气何时收集满 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落熔化物,防止集气瓶炸裂 |
A | B | C | D |
A. A B. B C. C D. D