题目内容
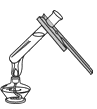
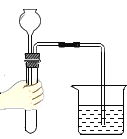
【题目】下图为实验室气体制备、干燥、性质实验的部分仪器。试根据题目要求,回答下列问题:
已知:![]()
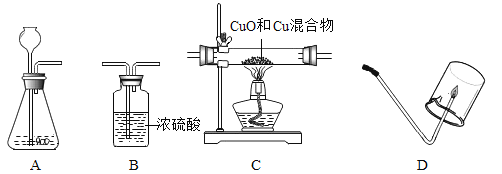
(1)若用Zn和H2SO4溶液反应制取干燥的氢气,并检验氢气的可燃性。
①所选仪器的连接顺序为:_____(填写仪器序号字母),点燃氢气前,先要检验氢气的_____;以免氢气发生爆炸。氢气燃烧的方程式是:_____。
②生成氢气时,所发生反应的化学反应方程式_____。
(2)若以H2O2溶液为原料(以MnO2为催化剂)在实验室中制备干燥的氧气。并用来测定CuO和Cu的混合物样品中CuO的含量,仪器的连接顺序为A→B→C。
①仪器B的作用是_____;
②仪器A中生成氧气的化学方程式是:_____;
③欲通过测量反应前、后C处大玻璃管质量的增加,来计算样品中CuO含量。若反应后大玻璃管中红色的Cu还没有完全消失,则样品中CuO含量的测算结果将_____(填“偏大”“偏小”“不受影响”)。
【答案】A→B→D 纯度 2H2+O2![]() 2H2O Zn+H2SO4=ZnSO4+H2↑ 吸收水分 2H2O2
2H2O Zn+H2SO4=ZnSO4+H2↑ 吸收水分 2H2O2![]() 2H2O+O2↑ 偏大
2H2O+O2↑ 偏大
【解析】
(1)①用锌与稀硫酸反应制取氢气是固体和液体的不加热反应,所以用装置A作为发生装置;要制取干燥的氢气,可使生成的气体通过浓硫酸吸收水分后,再用向下排空气法收集;氢气是可燃性气体,不纯点燃有爆炸的危险,所以要进行纯度的检验;氢气燃烧生成水,反应的方程式是:2H2+O2![]() 2H2O;
2H2O;
故填:A→B→D;纯度;2H2+O2![]() 2H2O;
2H2O;
②锌与硫酸的反应生成了硫酸锌和氢气,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑;
故填:Zn+H2SO4=ZnSO4+H2↑;
(2)①在实验室中制备并收集干燥的氧气,氧气和硫酸不反应,因此可以用浓硫酸吸收水分来干燥;
②以H2O2溶液为原料(以MnO2为催化剂)在实验室中制备氧气的化学方程式是2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
③若反应后大玻璃管中红色的Cu还没有完全消失,则质量增加的少,因此根据质量的增加计算出的铜的质量少,从而导致最终计算出的氧化铜的质量多,所以样品中CuO含量的测算结果将偏大;
故填:①吸收水分;②2H2O2![]() 2H2O+O2↑;③偏大。
2H2O+O2↑;③偏大。

 阶梯计算系列答案
阶梯计算系列答案【题目】下列各组物质的鉴别或除杂(括号内为杂质)的方案不可行的是
物质 | 方法或结论 | |
A | CO2(CO) | 通人氧气,点燃 |
B | 鉴别硬水和软水 | 加肥皂水,振荡后泡沫多、浮渣少的是软水 |
C | CuO(碳粉) | 在空气中燃烧 |
D | 检验甲烷中是否含有氢元素 | 点燃,在火焰上方罩一个冷而干燥的小烧杯 |
A.AB.AC.CD.D