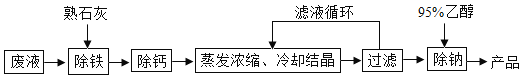
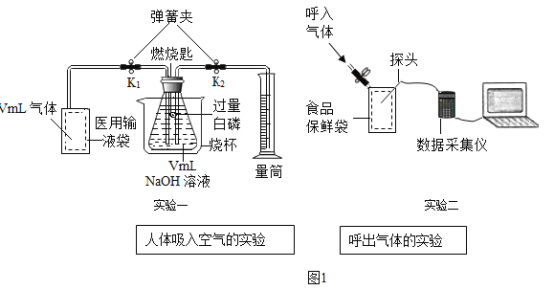
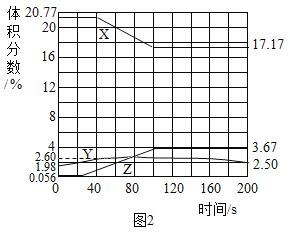
题目内容
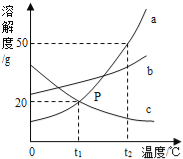
【题目】如图是甲、乙两种固体物质的溶解度曲线。
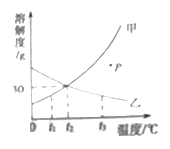
请回答:
(1)图中P点表示甲的溶液是_____(填“饱和”或“不饱和”)的溶液。
(2)要将t3℃时乙的饱和溶液变为不饱和溶液,可采取的方法是_____(填一种即可)。
(3)将t2℃甲的饱和溶液降温至t1℃时,所得溶液的溶质质量分数_____(填“变大”、“变小”或“不变”)。
【答案】不饱和 加溶剂(加水) 变小
【解析】
(1)从图中可以看出P点在甲溶液的溶解度曲线的下方,所以为甲的不饱和溶液;
(2)任何溶质的饱和溶液变为不饱和溶液都可通过加入加溶剂(加水)的方法,从图中可以看出乙的溶解度是随温度升高而降低,乙的饱和溶液降低温度也可变为不饱和溶液;
(3)从图中看出甲物质的溶解度随温度的升高而变大的,t2 ℃时的溶解度一定大于t1 ℃的,将t2 ℃甲的饱和溶液降温至t1 ℃时,一定会有甲物质析出,溶质质量会减少,溶剂质量不变,故溶质质量分数会减少。

 计算高手系列答案
计算高手系列答案【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
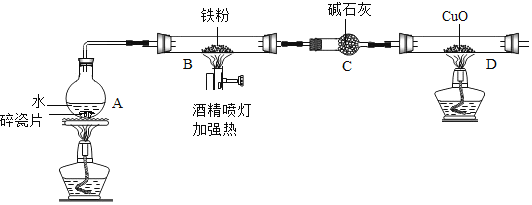
(1)(推断)观察到D中黑色固体变红,则B中生成的气体是______.
(2)探究B装置中剩余固体成分是什么?
(查阅资料)
(1)碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
(2)铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
(3)Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步探究)B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想与假设)
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是______
(实验探究)
实验操作 | 实验现象及结论 |
______ | ______ |
(实验结论)铁与水蒸气反应的化学方程式为______.