题目内容
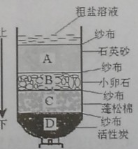
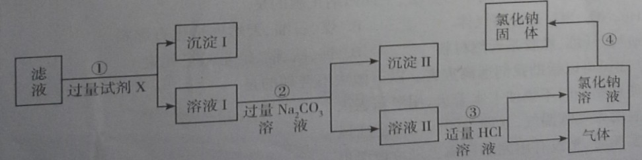
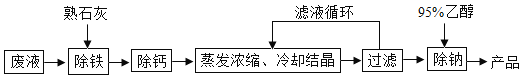
【题目】由氯化钡废液(杂质为FeCl3及微量NaCl)制备产品BaC122H2O的流程如图。
(1)氯化钡废液属于_____(填“纯净物”或“混合物”)。FeCl3中铁元素的化合价是_____。
(2)煅烧石灰石制取生石灰的化学方程式为_____,生石灰变成熟石灰的过程是_____过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变_____色。石灰石和熟石灰中常用于改良酸性土壤的是_____。
(3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl.C2H6O由_____种元素组成,是_____化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和_____。2个CO2分子可用化学符号表示为_____。煤、氢气、乙醇三种燃料中,最清洁的是_____。
(4)结合流程和表回答:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同;②_____。
表:每次结晶时,温度对产品纯度和产率的影响
冷却结晶的温度/℃ | 产品的纯度/% | 产品的产率/% |
5 | 99 | 72 |
25 | 99 | 60 |
【答案】混合物 +3价 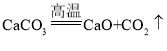 放热 蓝 熟石灰 3 有机 H2O 2CO2 氢气 25℃是常温,不需要专门降温
放热 蓝 熟石灰 3 有机 H2O 2CO2 氢气 25℃是常温,不需要专门降温
【解析】
(1)氯化钡废液中除了含有氯化钡、水外,还含有杂质FeCl3及微量NaCl,所以氯化钡废液属于混合物。FeCl3中氯元素显+1价,所以铁元素的化合价是:+3价。
(2)煅烧石灰石制取生石灰的化学方程式为: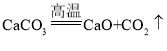 ;CaO+H2O=Ca(OH)2,反应中放热,所以生石灰变成熟石灰的过程是:放热过程;石灰水呈碱性,所以石灰水能使紫色石蕊试液变蓝色;石灰石难溶于水,而石灰水微溶于水且呈碱性,所以石灰石和熟石灰中常用于改良酸性土壤的是:熟石灰。
;CaO+H2O=Ca(OH)2,反应中放热,所以生石灰变成熟石灰的过程是:放热过程;石灰水呈碱性,所以石灰水能使紫色石蕊试液变蓝色;石灰石难溶于水,而石灰水微溶于水且呈碱性,所以石灰石和熟石灰中常用于改良酸性土壤的是:熟石灰。
(3)因为BaC122H2O易溶于水,不可用水洗涤,但用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl,因为BaC122H2O难溶于酒精,95%乙醇又含有5%的水,能溶解微量氯化钠。从酒精的化学式C2H6O可知酒精由3种元素组成;它是含碳化合物,所以是:有机化合物;酒精中含氢,因此C2H6O在O2中完全燃烧除了生成CO2还有:H2O;因为化学式前面的数字表示分子的个数,所以2个二氧化碳分子可用化学符号表示为:2CO2;因为氢气燃烧后只生成水,而煤燃烧后有二氧化硫、一氧化碳等有害气体生成,乙醇燃烧如果不充分,也会生成一氧化碳等有害气体,所以煤、氢气、乙醇三种燃料中,最清洁的是:氢气。
(4)结合流程和表可知:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是除了滤液多次循环后,25℃与5℃结晶产品的总产率基本相同外,因为25℃是常温,所以不需要专门降温,节约能源。因此第②个原因是:25℃是常温,不需要专门降温。

【题目】化学新材料的应用,使人们的生活质量不断提高。如表是不同年代常用的饭盒:
实物图片 |
|
|
|
|
名称 | 铝制饭盒 | 铁制饭盒 | 玻璃饭盒 | 塑料饭盒 |
(1)所标物质中含有的金属元素的是______,属于有机合成材料的是______。
(2)空气中,铝比铁具有更好的抗腐蚀性,原因是______(结合化学方程式解释)。写出一种铁制饭盒防锈的方法______。
(3)由饭盒所用材料的变迁,你得到的启示是______。
【题目】实验室中有 5 种没有标签的溶液,分别是Na2CO3、NaCl、Ca(OH)2、NaOH和稀盐酸,老师让化学实验小组同学鉴别这些溶液。
(查阅资料)无色、有刺激性气味的氯化氢气体溶于水得到盐酸。
(研究方式)从5种无色溶液中任意取出4种为一组进行鉴别。
(提出假设)同学们从5种无色溶液中取出4种,贴上A、B、C、D 标签,并且假设这一组溶液可能是Na2CO3、NaCl、Ca(OH)2、和稀盐酸。
(实验探究)同学们按以下步骤进行鉴别。
(第一步)取 4 支试管,分别加入少量的 A、B、C、D 溶液,然后依次加入少量稀盐酸,实验现象 记录见下表:
溶液 | A | B | C | D |
加入稀盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
①实验结论:C是_______溶液。
(第二步)依据下图装置进行实验,其中夹持固定装置已略去。从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化。
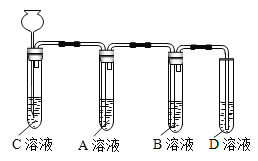
②实验结论:A是_______溶液。
(第三步)取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热。再取少量D溶液倒入另 一蒸发皿,加热,有白色固体析出,停止加热。
③实验结论:B是稀盐酸,D是NaCl溶液。
经过上述三步实验,同学们认为第 5 种无色溶液是NaOH溶液。
(实验反思)老师引导同学们讨论了上述实验探究过程并进行了全面反思。
①老师指出:实验结论仍有不确定性。不能确定的是_____溶液,其鉴别方法是________
②老师提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B 溶液,请在下列实验报告 中简述其实验步骤、现象和结论。
实验步骤 | 实验现象和结论 |
_______ | __________ |