题目内容
【题目】请用下列实验装置完成气体的制取及性质实验。
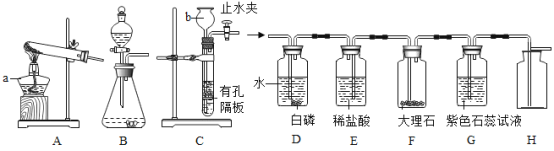
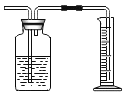
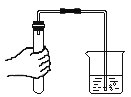
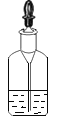
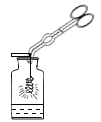
(1)仪器b的名称_____。
(2)用双氧水和二氧化锰混合制氧气,为了得到平稳的氧气流,应该选择的发生装置是(填序号)_____,反应的化学方程式为_____;当产生的氧气从D的左边导管通入时,很快看到G中导管口有气泡冒出;D中白磷始终没有燃烧的原因是_____;E中观察到的现象是_____。
(3)实验过程中,F中反应的化学方程式为_____;G中溶液由紫色变红色,G中颜色变化的原因是_____(用化学方程式表示)。
(4)用H装置可以收集剩余气体,H装置收集气体的依据是_____。
【答案】长颈漏斗 B 2H2O2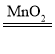 2H2O+O2↑ 温度没有达到白磷的着火点 稀盐酸液面下降,有溶液流入F装置 CaCO3+2HCl=CaCl2+H2O+CO2↑; CO2+H2O=H2CO3 二氧化碳气体的密度大于空气的密度
2H2O+O2↑ 温度没有达到白磷的着火点 稀盐酸液面下降,有溶液流入F装置 CaCO3+2HCl=CaCl2+H2O+CO2↑; CO2+H2O=H2CO3 二氧化碳气体的密度大于空气的密度
【解析】
过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,碳酸钙和盐酸生成氯化钙、水和二氧化碳。
①仪器b的名称是长颈漏斗。
②用双氧水和二氧化锰混合制氧气,为了得到平稳的氧气流,分液漏斗可以控制反应的速率,故应该选择的发生装置是B;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,反应的化学方程式为2H2O2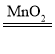 2H2O+O2↑,物质燃烧的条件是物质是可燃物,温度达到可燃物着火点以上,有氧气参与,故D中白磷始终没有燃烧的原因是温度没有达到白磷的着火点,随着气体的通入,E中的气压逐渐增大,故E中观察到的现象是稀盐酸液面下降,有溶液流入F装置。
2H2O+O2↑,物质燃烧的条件是物质是可燃物,温度达到可燃物着火点以上,有氧气参与,故D中白磷始终没有燃烧的原因是温度没有达到白磷的着火点,随着气体的通入,E中的气压逐渐增大,故E中观察到的现象是稀盐酸液面下降,有溶液流入F装置。
③F中反应是碳酸钙和盐酸生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,二氧化碳和水生成碳酸,碳酸能使紫色石蕊试液变红色,反应的化学方程式为CO2+H2O=H2CO3。
④剩余气体是二氧化碳,二氧化碳能溶于水,密度比空气的密度大,只能用向上排空气法收集,故H装置收集气体的依据是二氧化碳气体的密度大于空气的密度。

【题目】下列对某一主题的知识归纳,全部正确的一组是
A.水资源 | B.化学与健康 |
废水——生活污水直接排放 硬水和软水——可用肥皂水来检验 | 人体缺乏维生素B——引起坏血病 铁、锌、钙元素——都是人体必须的微量元素 |
C.微观粒子 | D. 食品安全 |
春天处处闻花香——分子在不停运动 硫离子结构示意图为: | 工业酒精——含有甲醇等有毒物质,不能饮用 黄曲霉素(C17H12O6)——属于有机物,食用霉变后含有黄曲霉素的食物可能诱发癌变 |
A. A B. B C. C D. D