题目内容
【题目】下列图形是实验中常用的装置,请根据要求回答问题:
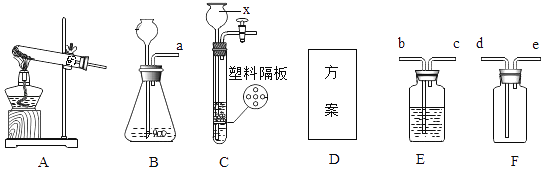
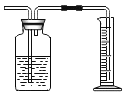
(1)若用氯酸钾和二氧化锰制取氧气,化学方程式是_____,气体发生装置应选用_____(填序号),向试管中加入药品前应先检验_____。
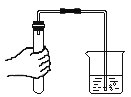
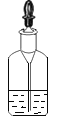
(2)仪器x的名称是_____;若要制得干燥的二氧化碳,除选择发生装置和收集装置外,还要选用装置_____,并在该装置中盛放_____(填药品名称),收集气体时气体应从_____端进入集气瓶;
(3)某研究性学习小组将蛋壳(主要成分类似石灰石)放入B的锥形瓶中,注入稀盐酸,并设计D方案检验产生的气体是什么,则D方案中的仪器和药品分别是_____、_____,D方案检验气体的原理是(用化学方程式表示)_____。
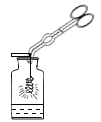
(4)图中C是一种改进装置(塑料隔板用来放置块状固体),若注入稀盐酸至淹没锌粒后,关闭活塞,可观察明显现象的是_____。
【答案】2KClO3![]() 2KCl+3O2↑ A 检查装置的气密性 长颈漏斗 E 浓硫酸 d 试管(或烧杯或广口瓶等) 澄清石灰水 CO2+Ca(OH)2═CaCO3↓+H2O 首先观察到有大量气泡产生,试管内液面逐渐下降至脱离锌粒,长颈漏斗的液面升高,反应停止
2KCl+3O2↑ A 检查装置的气密性 长颈漏斗 E 浓硫酸 d 试管(或烧杯或广口瓶等) 澄清石灰水 CO2+Ca(OH)2═CaCO3↓+H2O 首先观察到有大量气泡产生,试管内液面逐渐下降至脱离锌粒,长颈漏斗的液面升高,反应停止
【解析】
(1)氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气。化学方程式为2KClO3![]() 2KCl+3O2↑。因反应需要加热,故选用A装置。制取气体的装置在反应开始前应检验装置的气密性。
2KCl+3O2↑。因反应需要加热,故选用A装置。制取气体的装置在反应开始前应检验装置的气密性。
(2)x为常见的实验装置,为长颈漏斗。干燥二氧化碳可选用浓硫酸,故选用E装置,在此装置中盛放浓硫酸。二氧化碳的密度比空气的密度大,用F收集气体时气体应从长管进。
(3)因蛋壳主要成分类似石灰石,故加入稀盐酸后可能产生二氧化碳,可将产生的气体通入盛有澄清石灰水的试管中。二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O。
(4)关闭活塞后,产生的气体无法排出,使试管内压力增大,于是图中C的现象是:首先观察到有大量气泡产生,试管内液面逐渐下降至脱离锌粒,长颈漏斗的液面升高,反应停止。

 阅读快车系列答案
阅读快车系列答案