��Ŀ����
����Ŀ��ʵ������ƿ���˱����ڵĵ���ɫ����ҩƷ����ǩ������Ϊ���������ƣ�Na2O2������ij�о�С������ʦָ���¶���ɷֺ����ʽ�������̽����
���������ϣ���1������������һ�ֵ���ɫ���壬�����ں�����ߺ�DZͧ�в�����������ԭ���ǣ�2Na2O2+2H2O��4NaOH+O2����2Na2O2+2CO2��2Na2CO3+O2
��2�����¡���ѹ��O2���ܶ�Ϊ1.3g/L��
���������룩
��1����С��ͬѧ��Ϊ������ʵ�飬�Ϳ����жϸ�������һ����Na2O2��������_____��
��2����һ���Թ���ɷ�������²��룺I��ֻ��Na2O2������Na2O2��NaOH�������ʣ�����_____���������ʣ���������_____�������ʡ�
��ʵ��̽����
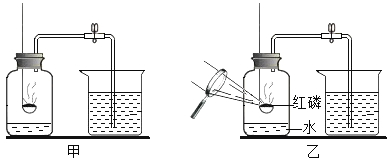
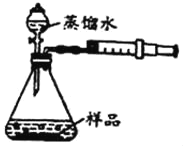
����ͼ����ʾ���Ӻ�װ�á��õ�����ƽ��ȡ2.00g��Ʒ�ڸ����װ���У���Һ©��������һ����������ˮ��
��3����Һ©����������ˮ�μӵ���ƿ�С���Ӧ��ȫ������ʣ�࣬ע�������ռ���80mL���壬˵����Ʒ�к���_____gNa2O2 �����������С�������λ����ͬ����
��4����Ӧ����Һ�еμӷ�̪����Һ�Ժ�ɫ��˵����Ӧ����Һ��_____��ѡ������������������������С����Ϊԭ����Ʒ����Ʒ��һ�������������ƣ�����Ϊ���Ĺ۵�_____��ѡ������ȷ����������ȷ������������_____��
��5����������ƿ�еμ��������Ȼ�����Һ���а�ɫ�������ɣ����ã��ϲ���Һ��ɫ���ʣ�����ʵ�����ȷ���μӷ�̪��Һǰ��ƿ����Һ���е�������_____���ѧʽ����
��6������ƿ�л���ᆳ�����ˡ�ϴ�ӡ�����ȣ��Ƶù�������Ϊ1.97g��
���ó����ۣ�
ͨ������ʵ��ó�����_____�������������Ƶ�����Ϊ_____g��
����˼����ߣ�
�������Ƴ��ڱ�¶�ڿ����У����ջ����Ϊ_____���ѧʽ����
���𰸡����������ǵ���ɫ���壬���������ƺ�̼���ƶ��ǰ�ɫ���� Na2O2��Na2CO3 Na2O2��NaOH��Na2CO3 0.51 ���� ����ȷ ������������ˮ��Ӧ�����������ƣ�̼������ҺҲ�Լ��� Na2CO3��NaOH �� 0.43 Na2CO3
��������
[��������]��1��������ʵ�飬���ɲ�õ����Ϻ���ѧ֪ʶ�Ϳ��ƶϸù���һ������Na2O2�������ǹ��������ǵ���ɫ���壬���������ƺ�̼���ƶ��ǰ�ɫ���塣������������ǵ���ɫ���壬���������ƺ�̼���ƶ��ǰ�ɫ���壻
��2����Ϊ��2Na2O2+2H2O��4NaOH+O2����2Na2O2+2CO2��2Na2CO3+O2�����Խ�һ���Թ���ɷ�������²��룺
��ֻ��Na2O2��
����Na2O2��NaOH�������ʣ�
����Na2O2��Na2CO3�������ʣ�
��������Na2O2��NaOH��Na2CO3�������ʡ�
���Na2O2��Na2CO3��Na2O2��NaOH��Na2CO3��
[ʵ��̽��]��3����Ӧ��ȫ������ʣ�ࣩ��ע�������ռ���80.0mL���壬����������������������Ϊ��1.3g/L��0.08L��0.104g��
�������������Ϊx��
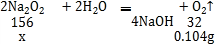
![]()
x��0.51g��
���0.51��
��4����Ӧ����Һ�еμӷ�̪����Һ�Ժ�ɫ��˵����Ӧ����Һ�Լ��ԣ�̼������Һ������������Һ���Լ��ԣ���������Ҳ����ˮ��Ӧ�����������ƣ�����С���Ĺ۵��Ǵ���ģ�������ԣ�����ȷ��������������ˮ��Ӧ�����������ƣ�̼������ҺҲ�Լ��ԣ�
��5���Ȼ������������Ʋ���Ӧ����������̼���Ʒ�Ӧ����̼�ᱵ��ɫ���������Լ�������ƿ�еμ��������Ȼ�����Һ���а�ɫ��������˵������ȷ���μӷ�̪��Һǰ��ƿ����Һ����̼���ƣ����ã��ϲ���Һ��ɫ���ʣ�˵������ȷ���μӷ�̪��Һǰ��ƿ����Һ�������������ƣ����Na2CO3��NaOH��
��6����̼���Ƶ�����Ϊy����
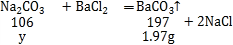
![]()
y��1.06g
[�ó�����]������ʵ����̡�ʵ�������֪���ù����к���Na2O2��NaOH��Na2CO3�������ʣ��������������
�����������Ƶ�����Ϊ��2.00g��0.51g��1.06g��0.43g���������0.43��
[��˼�����]�������Ʊ�¶�ڿ����У�������ж�����̼��Ӧ����̼���ƺ�������������е�ˮ������Ӧ�����������ƺ����������������������̼��Ӧ�ϳ�̼���ƣ����Թ������Ƴ��ڱ�¶�ڿ����У����ջ����Ϊ̼���ƣ����Na2CO3��