题目内容
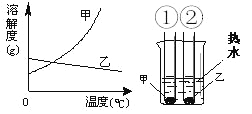
【题目】如图为氯化钠和碳酸钠的溶解度曲线,请回答:
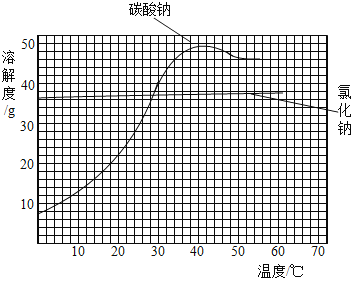
(1)20℃时向100g水中加入30g氯化钠,所得溶液为_____溶液(填“饱和”或“不饱和”);蒸发掉50g水后恢复到20℃,析出的固体质量为_____g。
(2)如图所示,向A、B两个烧杯中加入100g水,分别配成60℃的氯化钠和碳酸钠饱和溶液,冷却到10℃,析出固体较多的是______(填“A”或“B”)。
【答案】不饱和 11.5 B
【解析】
本题主要考察物质溶解性图像的相关知识
(1)20℃时,氯化钠的溶解度为37g,100g水中加入30g氯化钠固体所得溶液为不饱和溶液。50g水中溶解的氯化钠质量=![]() =18.5g,析出固体质量=30-18.5=11.5g。
=18.5g,析出固体质量=30-18.5=11.5g。
(2)由图像可知,碳酸钠解度受温度影响非常大,氯化钠溶解度几乎不厚温度影响,A、B两种饱和溶液降温后,析出固体较多的是B,即碳酸钠溶液析出固体较多。

 53天天练系列答案
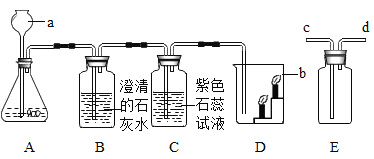
53天天练系列答案【题目】某研究小组发现,维C泡腾片(主要成分如图所示)溶于水,有许多气泡产生,小组同学对该气体的成分进行了如下探究:
(猜想与假设)
卓玛说:该气体可能是O2、H2、SO2、CO、CO2。
扎西说:不可能有SO2,因为________________。
德吉说:不可能有H2和CO,从药品安全角度考虑,H2易燃易爆,CO______。
讨论后,小组同学认为该气体可能有O2、CO2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)
(1)由实验①可知,该气体中肯定含有_________________,写出该反应的化学方程式:_______________________________。
(2)由实验②不能确定该气体中不含氧气,理由是________________。
(拓展延伸)向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显____性。
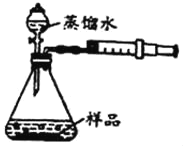
【题目】实验室可用下图所示装置来测定空气中氧气的含量。实验时可观察到:当红磷在集气瓶中燃烧停止后,集气瓶内水面上升大约1/5体积。请你回答:
(1)集气瓶内水面上升约1/5体积,由此你得到的结论是:_____________________。
(2)实验中的红磷需要稍微过量,目的是 。
请写出红磷燃烧这一反应的(文字或符号)表达式: 。
(3)通过这个实验,我们还可以认识氮气的一些性质。请将你的分析结果填在下表的横线上。
实 验 现 象 | 分 析 结 果(即氮气的性质) |
①燃烧着的红磷慢慢熄灭了 | |
③集气瓶内的水面上升一定高度后不再上升 |