题目内容
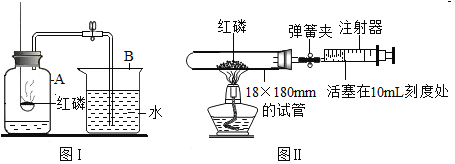
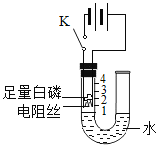
【题目】为测定空气中氧气的含量,小华和同学们设计了如图1所示的实验装置.实验时,在两个注射器组成的密闭系统为测定空气中氧气的含量,小华和同学们设计了如图1所示的实验装置.实验时,在两个注射器组成的密闭系统内留有30mL空气.然后给装有细铜丝的玻璃管加热,同时交替慢慢推动注射器活塞,观察实验现象.
(1)给装有细铜丝的玻璃管加热,同时交替慢慢推动注射器活塞的目的是_____。利用这种方法可以测定出空气中氧气含量的理由是______;同时这个实验还可以证明空气是一种混合物,其理由是_____;
(2)在实验过程中,可观察到铜丝逐渐由_____色变为_____色,发生反应的文字表达式为_____;
(3)停止加热冷却至室温,将气体全部推至一个注射器中,其读数应约为_____mL,
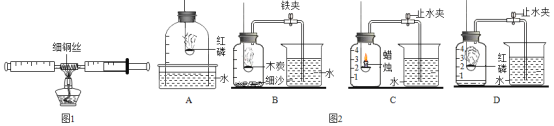
(4)根据上述实验的原理同学们又设计出如图2所示实验装置,你认为也可以用于测定空气中氧气含量的是______(填编号).
(5)你所选择的“测定空气中氧气体积含量”的实验中,观察到的实验现象是:_____.
(6)由以上出现的现象得出的结论是:_____.
【答案】使注射器中的氧气与铜充分反应 铜在加热条件下会和氧气反应生成固体氧化铜,减少的体积等于消耗的氧气体积 反应后活塞不能回到注射器顶部,证明还有剩余其他气体 红 黑 ![]() 24mL AD A中进入玻璃钟罩水的体积约为玻璃钟罩容积的1/5,D中进入集气瓶水的体积约为集气瓶容积的1/5 空气中氧气约占空气体积的1/5
24mL AD A中进入玻璃钟罩水的体积约为玻璃钟罩容积的1/5,D中进入集气瓶水的体积约为集气瓶容积的1/5 空气中氧气约占空气体积的1/5
【解析】
(1)交替推动活塞可使注射器中的氧气与铜充分反应,因铜在加热条件下会和氧气反应生成固体氧化铜,减少的体积等于消耗的氧气体积,可以用来测定空气中氧气的含量,反应后活塞不能回到注射器顶部,证明还有剩余其他气体,可以证明空气为混合物;
(2)红色的铜反应变为黑色氧化铜,反应文字表达式:![]() ;
;
(3)反应前气体总体积为30mL,氧气占空气总体积1/5,则反应后剩余气体占总体积4/5,故剩余气体体积为![]() ;
;
(4)AD中红磷只与氧气反应,且反应后生成固体五氧化二磷,进入水的体积等于消耗的氧气体积,可以用于测定空气中氧气的含量,BC反应后有二氧化碳气体生成,前后瓶内压强变化不大,不能测定氧气的体积;
(5)A中进入玻璃钟罩水的体积约为玻璃钟罩容积的1/5,D中进入集气瓶水的体积约为集气瓶容积的1/5;
(6)空气中氧气约占空气体积的1/5。

 阅读快车系列答案
阅读快车系列答案