题目内容
小明在做实验时发现实验室中有一瓶标签受损的无色液体,如图所示。小明的化学兴趣小组对此产生了疑问。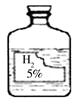
【提出问题】这瓶无色液体是什么呢?
【做出猜想】根据初中所学的化学知识,该液体只能是
过氧化氢溶液、碳酸、稀硫酸和蒸馏水中的一种。
【讨论交流】 大家讨论后一致认为
(1)不可能是蒸馏水,理由是 。
(2)不可能是碳酸,理由是碳酸不稳定,易分解。
【实验验证】
为确定该液体成分,同学们继续进行了如下实验探究:
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一: 取该液体适量于试管中,向其中加入少量 粉末 | 没有气泡产生。 | 该液体不是过氧化氢溶液。 |
| 步骤二: 取该液体适量于试管中,向其中滴加少量氯化钡溶液。 | | 该液体是稀硫酸。 |
【反思交流】
(1)大家认为标签受损的原因可能是 。
(2)如果该液体是过氧化氢溶液,请用化学方程式表示步骤一中所发生的化学反应: 。
【讨论交流】(1)由标签知该液体是混合物,而蒸馏水是纯净物
【实验验证】二氧化锰(MnO2 ) 产生白色沉淀
【反思交流】(1)倾倒液体时标签未朝向手心
(2)2H2O2 2H2O + O2↑
2H2O + O2↑
解析试题分析:【讨论交流】通过标签可以看出无色液体的溶质质量分数为5%,应该是一种溶液,所以不可能是蒸馏水,理由是由标签知该液体是混合物,而蒸馏水是纯净物
【实验验证】要探究是否是过氧化氢溶液,根据过氧化氢溶液和二氧化锰混合会迅速产生氧气的性质,所以实验操作是:取该液体适量于试管中,向其中加入少量二氧化锰粉末,若是稀硫酸,那么会与加入的氯化钡溶液反应,方程式为:H2SO4+BaCl2==BaSO4↓+2HCl,所以现象是:产生白色沉淀
【反思交流】(1)标签受损的原因可能是:倾倒液体时标签未朝向手心,这样残留的药品流下使标签腐蚀
(2)如果该液体是过氧化氢溶液,那么步骤一中所发生的化学反应方程式为:2H2O2 2H2O + O2↑
2H2O + O2↑
考点:实验探究题

 口算题天天练系列答案
口算题天天练系列答案(22分)著名侯氏制碱法的重要反应之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液。某化学兴趣小组欲探究所得滤液中溶质的成分,及制得的纯碱样品中Na2CO3的质量分数,请你参与他们的探究活动。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是 。
(2)化学兴趣小组经过讨论,认为猜想4可能是 。
【实验推断】
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 | | 滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量滤液于试管中,滴加稀盐酸。 | 产生无色 无味气体。 | 滤液中含有 ,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 | 产生白色沉淀。 | 滤液中含有 ,滤液蒸干后充分灼烧的目的是 。 |
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 | 产生白色沉淀。 | 反应的化学方程式: 。 |
(3)应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3 的质量分数为96%。如果不洗涤沉淀物会造成测定结果大于96%,这是因为 。
KOH溶液中含有H2O、K+、OH-、能使无色酚酞试液变成红色。某化学兴趣小组想探究KOH溶液使无色酚酞试液变成红色的原因。
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红。
猜想2:KOH溶液中的K+使无色酚酞试液变红。
猜想3:KOH溶液中的 (填化学式)使无色酚酞试液变红。
【实验探究】
| 实验操作 | 实验现象 | 结论 |
| ①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液 | 反应② 试管内溶液不变色 | 猜想1不成立 |
| ②用试管取少量KCl溶液,滴入1-2滴无色酚酞试液 | ________________ | 猜想2不成立 |
| ③________________,滴入1-2滴无色酚酞试液 | 试管内溶液变红 | ________________ |
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是_______________.
如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
请写出该中和反应方程式: 。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学: 。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是: 。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH (填“>”、“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
| 实验步骤 | 实验现象 | 实验结论 |
| | | |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
| 实验步骤 | 实验现象 | 实验结论 |
| | | |
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞实验,震荡.
现象:溶液变成浅红色.由此得出结论 ;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为 ;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如图所示装置进行实验
现象:充分加热后,大试管口有. 出现,管底有白色固体残留,
小试管中的现象. .
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
| 步骤 | 现象 | 结论 |
| 取样于试管中,往试管中滴加 | | |
(2)写出碳酸氢钠受热分解的化学方程式 ;
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 .




