题目内容
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞实验,震荡.
现象:溶液变成浅红色.由此得出结论 ;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为 ;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如图所示装置进行实验
现象:充分加热后,大试管口有. 出现,管底有白色固体残留,
小试管中的现象. .
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
| 步骤 | 现象 | 结论 |
| 取样于试管中,往试管中滴加 | | |
(2)写出碳酸氢钠受热分解的化学方程式 ;
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 .

(1)碳酸氢钠溶液的呈碱性 产生气泡 水珠 澄清石灰水变浑浊步骤 现象 结论 取样于试管中,往试管中滴加 稀盐酸 有气泡产生 留下的白色固体是Na2CO3
NaHCO3  Na2CO3+CO2↑+H2O 焙制糕点或治疗胃酸过多
Na2CO3+CO2↑+H2O 焙制糕点或治疗胃酸过多
解析试题分析:(1)碱或碱性溶液使紫色石蕊试液变蓝色,使无色酚酞试液变红色,溶液变成浅红色.由此得出结论碳酸氢钠溶液的呈碱性
(2)碳酸氢钠能与盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑,产生二氧化碳气体,所以有气泡
(3)结论告诉我们:碳酸氢钠受热能生成二氧化碳、水和一种白色固体,所以充分加热后,大试管口有水珠或水滴出现,由于产生了二氧化碳,小试管中的澄清石灰水变浑浊
(4)要证明是Na2CO3,而不是NaOH,那就应该抓住两者化学性质的不同,所以可用稀盐酸(或澄清石灰水、氯化钙溶液),若加入稀盐酸,Na2CO3会稀盐酸反应,产生气泡,而NaOH虽然也会与稀盐酸反应,但没有现象,若加入澄清石灰水或氯化钙溶液,Na2CO3会澄清石灰水或氯化钙溶液反应,均产生白色沉淀碳酸钙,而NaOH则不会反应,
(5)碳酸氢钠受热分解的化学方程式:NaHCO3 △Na2CO3+CO2↑+H2O, 碳酸氢钠在日常生活中的一种用途焙制糕点或治疗胃酸过多
考点:NaHCO3、Na2CO3和NaOH化学性质,

 名校课堂系列答案
名校课堂系列答案某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上字迹模糊。该同学进行了如下探究,请你参与探究并填空:
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥。
【提出猜想】该化肥所含的阴离子可能是Cl- 、CO32- 、SO42-中的一种或几种。
【实验、记录与分析】
| 实验操作步骤 | 实验现象 | 实验分析 |
| (1)取少量该化肥样品和少量熟石灰放在研钵中混合研磨 | | 含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加稀硝酸,过滤。 | 产生白色沉淀,沉淀不溶解 | 没有 存在 |
| (3)取(2)所得滤液少量于试管中,滴加 | | 有Cl- |
(写化学式)。
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
久置固体中可能含有Ca(OH)2的原因是:
用化学方程式表示 。
实验探究1:甲同学的方案(见下表)。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有 和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量 的 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有 , 一定不含有Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 | | 固体中一定含有CaCO3 |
实验质疑:(1)乙同学认为甲同学的实验中的实验中不能得出一定含有Ca(OH)2的结论,理由是 。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是 。
实验探究2:乙、丙同学设计如下图所示实验方案继续验证。

(1)③中反应的化学方程式是 。
(2)乙、丙同学实验中又能得出固体样品中一定还含有 ,
仍有一种物质不能确定,该物质是 。
老师在装有酸的储物柜中发现一瓶没有标签的溶液,让同学们鉴定该溶液是否为盐酸溶液。
| 实验步骤 | 实验现象 | 实验结论 |
| 1.取少量待测液体与试管中,滴加几滴石蕊溶液 | | 溶液呈酸性 |
| 2.取少量待测液与试管中,滴加 溶液 | 产生了白色沉淀 | 该待测溶液为盐酸 |
| 3.往上述2中的沉淀滴加 溶液 | |
写出上述操作2中所发生的化学方程式: 。
小明在做实验时发现实验室中有一瓶标签受损的无色液体,如图所示。小明的化学兴趣小组对此产生了疑问。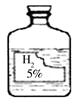
【提出问题】这瓶无色液体是什么呢?
【做出猜想】根据初中所学的化学知识,该液体只能是
过氧化氢溶液、碳酸、稀硫酸和蒸馏水中的一种。
【讨论交流】 大家讨论后一致认为
(1)不可能是蒸馏水,理由是 。
(2)不可能是碳酸,理由是碳酸不稳定,易分解。
【实验验证】
为确定该液体成分,同学们继续进行了如下实验探究:
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一: 取该液体适量于试管中,向其中加入少量 粉末 | 没有气泡产生。 | 该液体不是过氧化氢溶液。 |
| 步骤二: 取该液体适量于试管中,向其中滴加少量氯化钡溶液。 | | 该液体是稀硫酸。 |
【反思交流】
(1)大家认为标签受损的原因可能是 。
(2)如果该液体是过氧化氢溶液,请用化学方程式表示步骤一中所发生的化学反应: 。
某化学兴趣小组在实验室做了如图所示的A、B两个实验.
(1)B实验中发生反应的化学方程式为 .
(2)A、B两个实验结束后,小明同学将两支试管中的物质同时加入一纯净的烧杯中(如图C所示),混合后,观察到烧杯中有蓝色沉淀.同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究.
【猜想】
小明猜想:滤液中的溶质是Na2SO4、CuSO4;
小光猜想:滤液中的溶质是Na2SO4、NaOH;
小英猜想:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的猜想:滤液中的溶质还可能是 .
【讨论】你认为 的猜想一定不合理.如果滤液为无色,还可排除 的猜想,理由是 .
【实验】若小光的猜想正确,请完成下表的方案.
| 实验步骤 | 预想的实验现象 | 实验结论 |
| 取少量滤液与试管中,滴入 | | 小光的猜想正确 |


