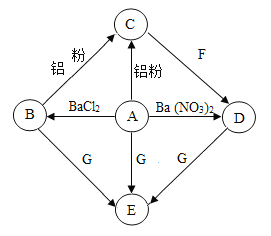
题目内容
【题目】从微观的角度了解物质及其变化,更有助于认识物质组成和变化的本质。
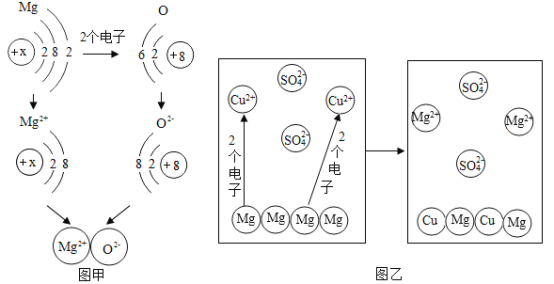
(1)图甲是镁与氧气生成氧化镁的微观示意图。
①反应中镁原子失去2个电子形成镁离子,在此过程中一定不会发生改变的是__________。
A元素种类 B元素化学性质 C最外层电子数 D原子核
②下列有关说法不正确的是__________________。
A每个镁原子失去2个电子形成镁离子,每个氧原子得到2个电子形成氧离子
B镁离子与氧离子电性相反,相互吸引,形成稳定化合物
C镁得到氧,化合价降低,发生氧化反应
(2)图乙为镁和硫酸铜溶液反应的微观示意图。写出发生反应的化学方程式______________。
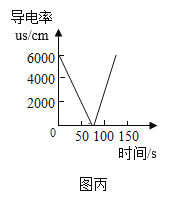
(3)图丙是向20mL1.6%的氢氧化钡溶液中滴加2滴酚酞,逐滴加入2%的硫酸铜溶液时所测得溶液导电率图。该反应的微观本质是_______。M点过后溶液导电率升高的原因是_____________。
(4)若化合价发生改变的反应属于氧化还原反应,上述三个反应中属于氧化还原反应的是_______(用甲、乙、丙填写)。
【答案】AD C ![]() Ba2+与SO42-结合生成BaSO4沉淀,Cu2+与OH-结合生成Cu(OH)2沉淀 反应结束后,硫酸铜溶液过量,溶液中自由移动的离子数目增加 甲、乙
Ba2+与SO42-结合生成BaSO4沉淀,Cu2+与OH-结合生成Cu(OH)2沉淀 反应结束后,硫酸铜溶液过量,溶液中自由移动的离子数目增加 甲、乙
【解析】
(1)①根据图示可知:反应中镁原子失去2个电子形成镁离子,最外层电子数改变,元素的化学性质也会改变,而元素的种类和原子核不变;故选AD;
②A、由图示可知,每个镁原子失去2个电子形成镁离子,每个氧原子得到2个电子形成氧离子,故A正确;
B、镁离子带正电,氧离子带负电,电性相反,相互吸引,形成稳定化合物,故B正确;
C、镁得到氧,化合价升高,发生氧化反应,故C错误;故选:C;
(2)根据镁和硫酸铜溶液反应的微观示意图可知,该反应是镁和硫酸铜生成铜和硫酸镁,反应的化学方程式为:![]() ;
;
(3)氢氧化钡溶液和硫酸铜溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的化学方程式为Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓,该反应的微观本质是Ba2+与SO42-结合生成BaSO4沉淀,Cu2+与OH-结合生成Cu(OH)2沉淀;溶液的导电能力与溶液中自由移动离子的浓度成正比,M点过后溶液导电率升高的原因是反应结束后,硫酸铜溶液过量,溶液中自由移动的离子数目增加;
(4)镁和氧气反应生成氧化镁,镁和氧的化合价都发生改变,属于氧化还原反应;
镁和硫酸铜溶液反应生成硫酸镁和铜,镁元素和铜元素的化合价改变,属于氧化还原反应;
氢氧化钡和硫酸铜反应生成硫酸钡沉淀和氢氧化铜沉淀,没有元素化合价的改变,不属于氧化还原反应;故填:甲、乙。

【题目】下表是20℃时部分物质的溶解度数据。
物质 | NaOH | AlCl3 | Al(OH)3 |
溶解度/g | 109 | 69.9 | 0.0015 |
氢氧化铝为两性氢氧化物,能与酸反应也,能与强碱反应,与氢氧化钠反应能生成偏铝酸钠(NaAlO2)和水
(1)配制溶液。其中配制20℃时100g饱和氯化铝溶液的基本步骤是:称取氯化铝固体—量取水—溶解—装瓶贴标签。
①称取氯化铝固体的质量_____________g。
②量取水加加入烧杯溶解。
③装瓶后贴标签,在标签上填写:_____________。
(2)进行性质探究实验。20℃时,根据数据回答下列问题:
①向氯化铝溶液中通入氢氧化钠直至过量,先生成Al(OH)3,再转化为NaAlO2,可观察到的现象是___________;Al(OH)3与氢氧化钠的反应方程式反应__________。
②将100g饱和氯化铝溶液,与足量的氢氧化钠反应能生成NaAlO2___________g,同时需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到0.1)
【题目】某食品包装袋上的说明如下:
商品名称 | XX饼干 |
配料 | 小麦、白砂糖、精炼植物油、鲜鸡蛋、奶油、食盐、膨松剂、食用香精 |
规格 | 400g |
储藏方法 | 存放于阴凉干爽处,避免阳光直射 |
保质期 | 270天 |
生产日期 | XXXX年XX月XX日 |
(1)在这种饼干的配料中,富含蛋白质的是______________,富含油脂的是_____________。葡萄糖(C6H12O6)在人体组织里在酶的催化作用下发生反应的化学方程式为________________。
(2)已知蛋白质中含N的质量分数约为15%,假设一个成年人从食物中提取的蛋白质经过人体新陈代谢后,完全转化为尿素CO(NH2)2排出体外,每天排出尿素25g。计算成年人每天从食物中摄取的蛋白质的质量不少于________g(列出算式即可)。