题目内容
【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如表:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
下列说法正确的是( )
A.反应后X的质量为1.4g
B.X中一定含有碳元素和氢元素
C.X中一定含有碳元素和氧元素
D.X中两种元素的质量比为1:1
【答案】AC
【解析】
由表中数据分析可知,反应前后乙醇的质量减少了2.3g﹣0g=2.3g,故乙醇是反应物,参加反应的乙醇的质量为2.3g;同理可以确定氧气是反应物,参加反应的氧气的质量为4g﹣0g=4g;二氧化碳是生成物,生成的二氧化碳的质量为2.2g﹣0g=2.2g;水是生成物,生成的水的质量为:2.7g﹣0g=2.7g;由质量守恒定律,X是生成物,且生成X的质量为2.3g+4g﹣2.2g﹣2.7g=1.4g,故待测的数值为1.4g﹣0g=1.4g。
A、由以上分析可知,反应后X的质量为1.4g,故A正确;
B、由化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数可以计算出:2.3g乙醇中碳、氢、氧三种元素的质量分别是![]() ,
,![]() ,
,![]() ;2.2g二氧化碳中碳、氧两元素的质量分别是
;2.2g二氧化碳中碳、氧两元素的质量分别是![]() ,
,![]() ;2.7g水中氢、氧两元素的质量分别为
;2.7g水中氢、氧两元素的质量分别为![]() 、
、![]() 。因此反应物中共有1.2g碳元素、0.3g氢元素、4.8g氧元素,生成物二氧化碳和水中共有0.6g碳元素、0.3g氢元素、4g氧元素.根据质量守恒定律可知:反应物中有0.6g碳元素和0.8g氧元素进入了生成物X中,说明生成物X由碳、氧两元素组成,X中不含氢元素,故B错误;
。因此反应物中共有1.2g碳元素、0.3g氢元素、4.8g氧元素,生成物二氧化碳和水中共有0.6g碳元素、0.3g氢元素、4g氧元素.根据质量守恒定律可知:反应物中有0.6g碳元素和0.8g氧元素进入了生成物X中,说明生成物X由碳、氧两元素组成,X中不含氢元素,故B错误;
C、根据B选项的分析,物质X一定含有碳元素和氧元素,故C正确。
D、根据B选项的分析,可知生成物X中碳元素和氧元素的质量比为:0.6g:0.8g=3:4;故D错误。故选AC。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】下表是20℃时部分物质的溶解度数据。
物质 | NaOH | AlCl3 | Al(OH)3 |
溶解度/g | 109 | 69.9 | 0.0015 |
氢氧化铝为两性氢氧化物,能与酸反应也,能与强碱反应,与氢氧化钠反应能生成偏铝酸钠(NaAlO2)和水
(1)配制溶液。其中配制20℃时100g饱和氯化铝溶液的基本步骤是:称取氯化铝固体—量取水—溶解—装瓶贴标签。
①称取氯化铝固体的质量_____________g。
②量取水加加入烧杯溶解。
③装瓶后贴标签,在标签上填写:_____________。
(2)进行性质探究实验。20℃时,根据数据回答下列问题:
①向氯化铝溶液中通入氢氧化钠直至过量,先生成Al(OH)3,再转化为NaAlO2,可观察到的现象是___________;Al(OH)3与氢氧化钠的反应方程式反应__________。
②将100g饱和氯化铝溶液,与足量的氢氧化钠反应能生成NaAlO2___________g,同时需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到0.1)
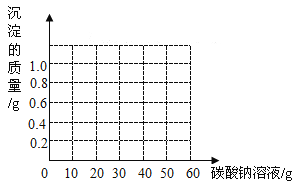
【题目】某班同学在做完“二氧化碳的制取和性质”实验后,废液缸内盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行探究,某小组同学做了如下实验:取废液缸上层清液 20 g于烧杯中,逐滴滴入5.3% 的碳酸钠溶液使其恰好完全反应。有关实验数据记录下表,当碳酸钠溶液加至50g(已过量)时,将杯中物质进行过滤后得干燥固体1.0g,其他数据记录如下表:
测定次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入的Na2CO3溶液/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
烧杯中物质总质量/g | 29.78 | 39.56 | 49.56 | 59.56 | 未测 |
(1)盐酸完全反应时生成二氧化碳的质量为____________。
(2)计算20g废液中含氯化氢的质量___________。
(3)通过计算,请在图中画出生成沉淀随加入Na2CO3溶液质量变化的曲线。___________