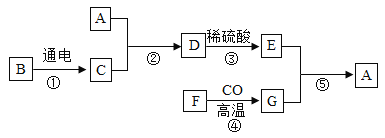
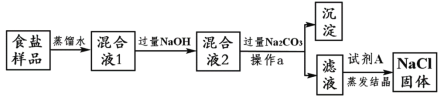
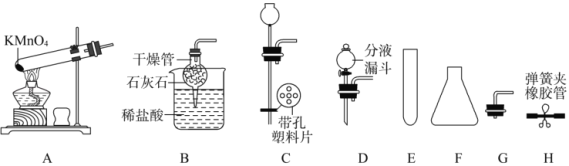
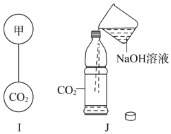
题目内容
【题目】宜城葛洲坝水泥厂生产的水泥畅销各地,生产的原料之一是石灰石。某化学兴趣小组对石灰石纯度进行探究。取该石灰石样品16g,把200g稀盐酸分四次加入,测量探究过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水也不与稀盐酸反应)。请计算:
序号 | 加入稀盐酸的质量/g | 剩余固体质量/g |
第1次 | 50 | 11 |
第2次 | 50 | 6 |
第3次 | 50 | 3.2 |
第4次 | 50 | m |
(1)表中m的数值为 ;石灰石纯度是 。
(2)求第2次反应完毕后所得溶液溶质的质量分数(写出解题过程,结果精确到0.1﹪)
【答案】(1)3.2;80%;(2)
【解析】
(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,由表中数据可知,第一次加入50g稀盐酸,完全反应,消耗的碳酸钙的质量为16g-11g=5g;第二次加入50g稀盐酸,完全反应,消耗的碳酸钙的质量为11g-6g=5g;第三次加入50g稀盐酸,若完全反应,消耗的碳酸钙的质量为5g,剩余的固体质量应为6g-5g=1g,而实际剩余的固体质量为3.2g,说明此次碳酸钙已经完全反应,第四次再加入50g稀盐酸,固体的质量不变,所以m=3.2。
石灰石纯度是:![]() ×100%=80%。
×100%=80%。
(2)解:设第2次反应完毕后所得氯化钙质量为![]() ,同时生成二氧化碳质量为
,同时生成二氧化碳质量为![]() 。
。
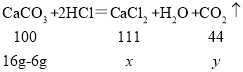
![]()
![]()
![]() =11.1g
=11.1g ![]() =4.4g
=4.4g
所得溶液质量分数为:![]() ×100%
×100%![]() 10.5%
10.5%
答:第2次反应完毕后所得溶液溶质的质量分数为10.5%。

【题目】为了测定实验中氯酸钾样品的纯度,某兴趣小组取2.5克样品与0.8克二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以下操作,依次称得加热t1、t2、 t3、t4时间后剩余固体的质量,记录数据如表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.41 | 2.34 | 2.34 |
请仔细分析实验数据,回答下列问题:
(1)在多长时间后,该样品中的氯酸钾已经反应完全。
(2)计算完全反应后生成氧气的质量为多少。
(3)求该样品中氯酸钾的质量分数。