题目内容
【题目】材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
(一)单质铁钉的一系列变化。
![]()
(1)变化①的原因是铁与空气中的水、______等物质发生一系列复杂反应的结果。
(2)变化②的实验现象是:铁锈消失,______,发生反应的化学方程式为______
(二)铁及其化合物的实验
硫酸亚铁铵(俗称摩尔盐)化学式为FeSO4· (NH4)2SO4· 6H2O,是一种重要的化工原料, 用途十分广泛。
Ⅰ 硫酸亚铁铵晶体制备。 资料:溶质从溶液里结晶析出时,晶体里结合着一定数目的水分子,这样的水分子叫结晶水。 硫酸亚铁铵晶体易溶于水,不溶于乙醇。
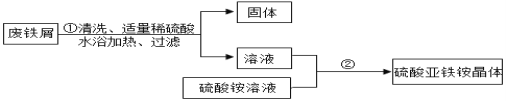
(1)在步骤①前要对废铁屑进行预处理,先利用洗涤剂的______作用除去油污。
(2)操作②中发生了一系列变化,目的是得到硫酸亚铁铵晶体。其中的操作顺序是: b→______→______→d;
a 过滤b 加热浓缩c 降温结晶d 洗涤干燥
(3)操作②中使用乙醇洗涤。这样做的优点是______;
A 避免用水洗涤所造成的晶体损耗B 酒精易挥发,可低温晾干晶体
Ⅱ 硫酸亚铁铵晶体热分解实验
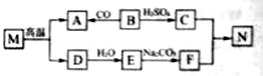
兴趣小组称取此晶体样品 39.2g,在科研人员的指导下用如图装置进行热分解实验。
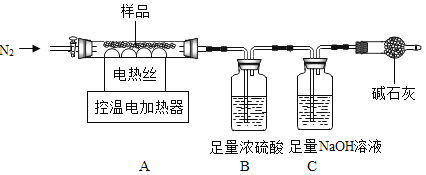
(查阅资料)①硫酸亚铁铵晶体在 200℃完全失去结晶水,剩余物在 500℃完全分解为铁的某氧化物、SO2、SO3、NH3 和 H2O。
②B 装置中浓硫酸只能吸收 NH3、SO3 和 H2O。
(1)装配好实验装置后,先要______。
(2)控制不同的温度对 A 中固体加热,测得装置 B 和 C 中的质量变化如表。
A装置中温度/℃ | 室温 | 100 | 500 |
B装置/g | 200.00 | X | 228.00 |
C装置/g | 100.00 | 100.00 | 103.20 |
①表格中 X=______。
②请你根据表中实验数据,计算出最终生成的 SO3 质量______?(写出计算过程)
(3)加热前后及过程中均需通入 N2,停止加热后继续通 N2 的目的是防止液体倒吸和______
【答案】O2 溶液变黄 ![]() 乳化 c a AB 检查装置的气密性 200.00 12g 将反应生成的气体全部排出,得以全部吸收
乳化 c a AB 检查装置的气密性 200.00 12g 将反应生成的气体全部排出,得以全部吸收
【解析】
(一)(1)铁需要同时与氧气(O2)和水接触才能生锈;
(2)氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为![]() ,硫酸铁溶液为黄色,因此可以看到溶液变为黄色;
,硫酸铁溶液为黄色,因此可以看到溶液变为黄色;
(二)Ⅰ(1)去除油污一般选用洗涤剂,利用乳化剂的乳化作用去除油污;
(2)蒸发结晶过程主要包括加热浓缩、降温结晶、过滤、洗涤干燥,得到最终的晶体;
故填:c;a。
(3)使用酒精作为洗涤剂,可以减少硫酸亚铁铵晶体被溶解,同时干燥时,酒精易挥发,得到干燥晶体;
故填:AB。
Ⅱ(1)实验过程中会生成气体,避免气体逸出,影响实验结果,需要检查装置气密性;
(2)①在100℃时,没有达到结晶水完全失去的温度,因此此时质量不变,所以X为200.00g;
②样品中硫元素质量=![]() ,而C中增加的质量为二氧化硫质量,其中硫元素质量=
,而C中增加的质量为二氧化硫质量,其中硫元素质量=![]() ,因此剩余硫元素质量=6.4g-1.6g=4.8g,设三氧化硫质量为m,
,因此剩余硫元素质量=6.4g-1.6g=4.8g,设三氧化硫质量为m,![]() ,m=12g;
,m=12g;
答:三氧化硫的质量为12g。
(3)内部容易残留气体,无法全部被吸收,所以需要通入氮气,将反应生成的气体全部排出,得以全部吸收,保证实验结果的准确性。