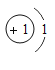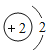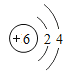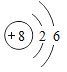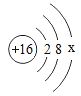题目内容
【题目】在“宏观一微观一符号”之间建立联系,是化学特有的思维方式。
(1)下表为部分元素的原子结构示意图:
元素名称 | 氢 | 氦 | 碳 | 氧 | 钠 | 硫 |
元素符号 | H | He | C | O | Na | S |
原子结构示意图 |
|
|
|
|
|
|
请回答下列问题:
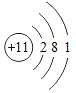
①表中硫原子结构示意图中,最外层电子数x=_____;
②原子的核外电子排布,特别是最外层的电子数目,与元素的性质有密切的关系。表中具有相对稳定结构的原子是_____(填元素符号);
③在化学反应中,如果有元素化合价升高,则一定有元素化合价降低,这样的反应叫做氧化还原反应。在四种基本化学反应类型中,_____反应一定不是氧化还原反应;在NaH与水反应中,只有一种元素的化合价发生改变,生成物除NaOH外,另一种产物的化学式是_____。
(2)汽车尾气催化转换器可减少有害气体排放,其反应过程的微观变化如图:
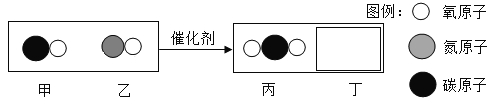
①已知丁是一种单质,则丁是_____(写化学式);
②根据以上微观示意图得出的结论中,正确的有_____。(填字母序号)
A 该反应中含氧元素的物质有3种
B 该反应是置换反应
C 参加反应的甲和乙的质量比为14:15
D 生成丙和丁的分子个数比为2:1
【答案】6 He 复分解 H2 N2 ACD
【解析】
(1)①在原子中,质子数=核外电子数,所以表中硫原子的最外层电子数x+2+8=16,则x=6。故答案为:6;
②当原子的最外层电子数为8(若只有一个电子层,则最外层电子数为2)时,则属于相对稳定结构。图中B的最外层电子数为2,且质子数=电子数,属于相对稳定的结构的原子。故答案为:He;
③复分解反应的特点是:两种化合物交换各自的组成成分,且各元素的化合价不变。所以复分解反应一定不属于氧化还原反应。在NaH中,氢元素的化合价为-1价,钠元素的化合价为+1价。与水反应中,只有一种元素的化合价发生改变,生成物NaOH中,钠元素显+1价,氢元素显+1价,氧元素显-2价。说明氢元素的化合价已经改变,且升高。所以应该是水中氢元素的化合价降低。水中氢元素化合价为+1价,所以可以推测出生成的物质是氢气。故答案为:复分解、H2;
(2)①根据质量守恒定律可知,反应前后元素的种类不变。所以可以推测丁物质应该是氮气。则可以分析出,该反应是一氧化碳和一氧化氮在催化作用下生成二氧化碳和氮气。故答案为:N2;
②根据图示可以写出该反应的方程式为: 。则可以分析出:
。则可以分析出:
A、该反应中含有氧元素的物质为一氧化碳、一氧化氮、二氧化碳,三种物质。A正确;
B、该反应的反应物都是化合物,生成物是单质和化合物,不属于四大基本反应类型。B错误;
C、该反应中甲是一氧化碳,乙是一氧化氮。参加反应的甲和乙的微粒个数是2:2=1:1。C正确;
D、生成的丙物质是二氧化碳,丁物质是氮气。生成的两种物质的分子个数比为2:1。D正确。
故答案为:ACD。

 阅读快车系列答案
阅读快车系列答案【题目】某同学为了寻找含碳酸钙质量分数超过85%的石灰石,现实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,为了测定该碳酸钙混合物是否符合标准,该同学用相同溶质质量分数的稀盐酸和该混合物反应,四组实验数据记录如下表。所得溶液均为不饱和溶液请分析计算:
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)分析表中数据,判断实验三中的样品是否已完全反应并写出理由:_____。
(2)通过计算推断该石灰石样品的纯度是否符合要求_____;
(3)表中a的值为_____,表中m的值为_____。