题目内容
【题目】化学小组进行如图所示实验:将稀盐酸、稀硫酸分别加入到装有少量氧化铜粉末的试管甲、乙中,微热,观察到黑色固体完全溶解,试管甲中的溶液显绿色,试管乙中的溶液显蓝色。激发了他们的兴趣,进行如下探究活动。
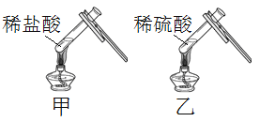
(1)写出氧化铜与稀盐酸反应的化学方程式______。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
(查阅资料)
氯化铜溶液与硝酸银溶液反应的化学方程式为:CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
(猜想与假设)①硫酸铜溶液显蓝色与硫酸根离子有关;
②氯化铜溶液显绿色与氯离子有关。
(实验1)
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液显______色,说明硫酸铜溶液显蓝色与硫酸根离子无关,与铜离子有关。
(实验2)
(3)小组的操作:取试管乙中的溶液滴加一定量的______,观察到溶液由蓝色变绿色,则猜想②成立。
(4)请你再设计一个实验证明猜想②成立。实验方案:取试管甲中的溶液,______(请简述实验操作与现象)。
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
(实验3)
步骤Ⅰ. 用托盘天平称取无水氯化铜固体5.0 g置于小烧杯中;
步骤Ⅱ. 往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表:
加入水的体积/mL | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
溶液颜色 | 深绿 | 墨绿 | 墨绿 | 蓝绿 | 绿色 | 深蓝 | 蓝色 | 蓝色 | 浅蓝 | 淡蓝 |
(5)上述实验可以得到的结论是______。
(6)仅从上述实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过______(数据精确到0.1%)。
探究三:氯化铜溶液显绿色是否与溶液的温度有关。
(实验4)
化学小组同学利用数字化技术研究温度对溶液颜色的影响。取50 mL溶质质量分数为10%的氯化铜蓝色溶液作为待测液,用色度计测定其透光率,绘出如图(透光率越小,溶液颜色越深,透光率越大,溶液颜色越浅)。
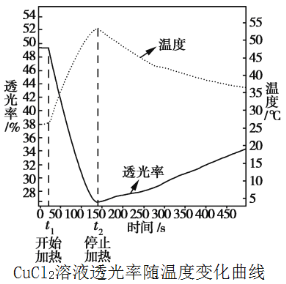
(7)上述实验结果表明:加热过程中,氯化铜溶液的颜色______(填“变深”、“变浅”或“不变”)。
【答案】CuO+2HCl=CuCl2+H2O 蓝色 NaCl(或其他合理答案) 滴加过量硝酸银溶液,观察到的白色沉淀生成,绿色溶液变蓝色。 氯化铜溶液显绿色与溶液的浓度有关 14.3% 变深
【解析】
稀盐酸和氧化铜反应生成氯化铜和水,稀硫酸和氧化铜反应生成硫酸铜和水。
(1)氧化铜与稀盐酸反应生成氯化铜和水,化学方程式为![]() 。
。
[实验1]
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,反应生成硝酸铜和水,加热,观察到黑色固体完全溶解,溶液显蓝色,说明硫酸铜溶液显蓝色与硫酸根离子无关,与铜离子有关。
[实验2]
(3)小组的操作:取试管乙中的溶液滴加一定量的NaCl,观察到溶液由蓝色变绿色,则猜想②成立。
(4)验证②氯化铜溶液显绿色与氯离子有关,氯离子和银离子生成氯化银白色沉淀,故实验方案是取试管甲中的溶液,滴加过量硝酸银溶液,观察到的白色沉淀生成,绿色溶液变蓝色。
[实验3]
(5)由表格中的数据,随着水的体积的增加,溶液的颜色变淡,故实验可以得到的结论是氯化铜溶液显绿色与溶液的浓度有关。
(6)从实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过
![]() ,故溶液中溶质质量分数不超过14.3%。
,故溶液中溶质质量分数不超过14.3%。
[实验4]
(7)氯化铜的透光率随着温度的增加而降低,故实验结果表明:加热过程中,氯化铜溶液的颜色变深。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
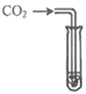
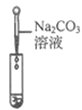
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。