��Ŀ����
����Ŀ����15�֣�������㳣��Na2CO3��NaHCO3�����ɼ�����У��ѧ��ȤС���ͬѧ����Na2CO3��NaHCO3�����ʽ�����һϵ��̽����
���������ϡ�
��1���ܽ�ȱȽϣ�
��2����֪̼��������270�����Ҿ��ֽܷ�Ϊ̼���ơ�ˮ�Ͷ�����̼����̼�������Ȳ��ֽ⡣
��3�������£�Ũ����ͬ��Na2 CO3��Һ��NaHCO3��Һ�ļ���ǿ��
��̽��һ��NaHCO3��Na2CO�ܽ�Ȳ����̽����
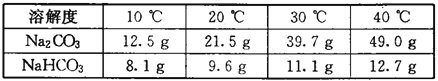
С��ͬѧ�ֱ�ȡxg���ֹ����ĩ����20��10 gˮ�г���ܽ⣬ͨ���۲��������ֳ�̼���ƺ�̼�����ƣ�x������_______��
A��2 B��0��96 C��0��5 D��3
��̽������Na2CO3��NaHCO3����̽��
����������衿
��1����ͬѧ��Ϊ���ó���ʯ��ˮ����Na2CO3��NaHCO3��Һ��
��3����ͬѧ��Ϊ����Na2CO3��NaHCO3���ü��ȵķ�������
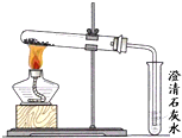
��ʵ��̽������1����ͬѧ����֧�ֱ�ʢ������Na2CO3��NaHCO3��Һ���Թ��У����������ʯ��ˮ���۲쵽��֧�Թ��е�������ͬ���������˰�ɫ������ʵ��������벻һ�£��������ó���ʯ��ˮ����Na2CO3��NaHCO3��Һ��
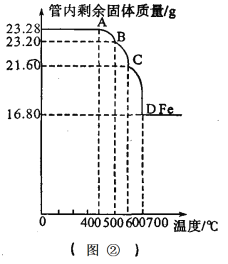
��3����ͬѧ�ֱ�ȡ��һ������Na2CO3��NaHCO3�����ڴ��Թ��м��ȣ���ͼ��ʾ����
�ټ���Na2CO3ʱ����ʼ����С�Թ������������ݲ������������ȣ��������٣�δ������ʯ��ˮ����ǣ�
�ڼ���NaHCO3ʱ����ͬѧ�۲쵽ʵ��������ٲ�ͬ��֤ʵ���Լ��IJ����Ǻ����ģ�
���������ۡ�
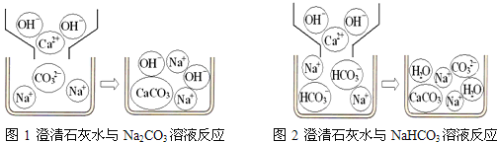
С��ͬѧ������ʵ��չ�������ۣ��Լ�ͬѧ������ʵ������˱Ƚϣ�������������Һ�н������ͬ���ӵ��۽Ƕȷ�����ԭ����ͼ1��ͼ2������д��Na2CO3�����ʯ��ˮ������Ӧ�Ļ�ѧ����ʽ________��д��NaHCO3�����ʯ��ˮ���ʱ���뷴Ӧ�����ӣ�________��
��̽�������ⶨijNa2CO3��NaHCO3�������NaHCO3����������
[����һ]��ȡһ��������Ʒ�����������м��������غ���ȴ������ʣ��������������㡣
��1�������з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��2��ʵ���У�����������ص�Ŀ���� ��
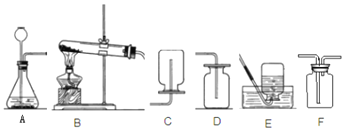
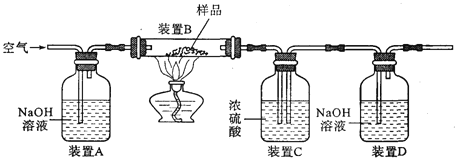
[������]������ͼװ�ý���ʵ�飬װ��B�з�����Ʒ������װ�����������ã���װ�����������ռ���������
��ʵ�鲽�衿
��1�����װ�õ������ԣ���2����ȡ��Ʒ10 g���ӵ�װ��B�У���3������װ��B��C��D����������ҩƷ������4������װ�ã���5�����ȣ���6��ֹͣ���ȼ���ͨ���������7���ٴγ���װ��B��C��D����������ҩƷ����
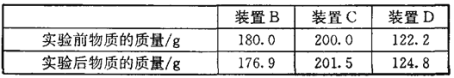
�����ݼ�¼��
������ش�
����ͼװ��C��������_______��װ��C��һ�����ԵĴ�����______________��
��ʵ������б�����װ����ͨ�������װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_______����û��װ��A����ɲⶨ���_______���ƫ�����䡱��ƫС����
�����۷�����
С��ͬѧ��Ϊ���������������ݶ����Լ������Ʒ��NaHCO3��������������С����Ϊ������Cװ�õ������仯�����㣬��������_______���Ľ�������_______��С������Ϊ��װ��D���������ƫ���Ӱ����㣬Ӧ����һ��������_______��Ŀ����______________��
�����ݴ����������������ۣ����һ����Ӧ�����ñ����е�װ��B�������仯���м���NaHCO3��Na2CO3�������NaHCO3���������� ��
����չӦ�á�����Na2CO3�л�������NaHCO3����ͨ��________������ȥ��
���𰸡���̽��һ��A
��̽���������������ۡ���1��Na2CO3+Ca(OH)2��CaCO3��+2NaOH OH-��HCO3-��Ca2+
��̽������[����һ]��1��2NaHCO3��Na2CO3+H2O+CO2�� ��2����֤NaHCO3 ȫ���ֽ�
[������]������ˮ���� �Ҳർ������Һ������ ��2NaOH+CO2=Na2CO3+H2O ƫ��
�����۷�����װ��A���ݳ���ˮ���������װ��C��
��װ��A��B֮������һ��Ũ����ĸ���װ��
����Dװ��ǰ������������� �ž�װ���ڵĶ�����̼����
�����ݴ�����84% ����չӦ�á�����
��������
�����������̽��һ�����ݱ����е��ܽ�����ݣ���20��ʱ��NaHCO3���ܽ��Ϊ9��6g��Na2CO3���ܽ��Ϊ21��5g����10gˮ��������ܽ�NaHCO3��Na2CO3�������ֱ�Ϊ0��96g��2��15g���ʿ��Լ���0��96g<x<2��15g���ʿ��Լ���2g���ʣ��۲��ܽ���������ȫ���ܽ�ΪNa2CO3���������ܽ�ΪNaHCO3����ѡA
��̽���������������ۡ���1��Na2CO3��Һ�����ʯ��ˮ������Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+Ca(OH)2��CaCO3��+2NaOH��ͨ���۲�ͼ2��NaHCO3�����ʯ��ˮ���ʱ���뷴Ӧ�����ӣ�OH-��HCO3-��Ca2+
��̽������[����һ]��1��������Ϣ��̼��������270�����Ҿ��ֽܷ�Ϊ̼���ơ�ˮ�Ͷ�����̼����̼�������Ȳ��ֽ⣬�������з�����Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3��Na2CO3+H2O+CO2��
��2��ʵ���У�����������ص�Ŀ���ǣ���֤NaHCO3 ȫ���ֽ�
[������]��װ��C�е�ҩƷ��Ũ���ᣬŨ���������ˮ�ԣ���װ��C�������ǣ�����ˮ������װ��C��һ�����ԵĴ����ǣ��Ҳർ������Һ��������Ӧ���ö̹ܣ����������Ų�����
��ʵ������б�����װ����ͨ�������װ��A������������Һ�����տ����еĶ�����̼���ʷ�����Ӧ�Ļ�ѧ����ʽΪ��2NaOH+CO2=Na2CO3+H2O����û��װ��A��������еĶ�����̼�ͻ���絽װ��D�У��Ӷ�ʹ������̼������ƫ����ɲⶨ���ƫ��
�����۷�����С��ͬѧ��Ϊ���������������ݶ����Լ������Ʒ��NaHCO3��������������С����Ϊ������Cװ�õ������仯�����㣬�������ǣ�װ��A���ݳ���ˮ���������װ��C�����Ľ���������װ��A��B֮������һ��Ũ����ĸ���װ����С������Ϊ��װ��D���������ƫ���Ӱ����㣬Ӧ����һ������������Dװ��ǰ���������������Ŀ���ǣ��ž�װ���ڵĶ�����̼����
�����ݴ��������ñ����е�װ��B�������仯���м���NaHCO3��Na2CO3�������NaHCO3��������������װ��B�з�Ӧǰ����ٵ�����Ϊ̼�����Ʒֽ������ˮ�Ͷ�����̼���������ʿɸ��ݻ�ѧ����ʽ��2NaHCO3��Na2CO3+H2O+CO2����NaHCO3��ˮ�Ͷ�����̼��������ϵΪ168:62����װ��B��Ӧǰ���������=180g-176��9g=3��1g���ʿɼ����NaHCO3������=168��3��1g��62=8��4g���ʻ������NaHCO3����������=8��4g/10g��100%=84%
����չӦ�á�����Na2CO3�л�������NaHCO3����ͨ������������ȥ

����Ŀ����ȥ���������е��������ʣ���ѡ�õ��Լ��ͷ�������ȷ����
ѡ�� | ���ʣ�������Ϊ����) | �Լ� | �������� |
A | CO2��CO) | ����O2 | ��ȼ |
B | CaO��CaCO3) | ����ϡ���� | �������ᾧ |
C | NaNO3��Һ��Na2SO4) | ����̼�ᱵ���� | ���� |
D | Cu�ۣ�Fe��) | ����ϡ���� | ���ˡ�ϴ�ӡ����� |