题目内容
【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
(知识回放)
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)________Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。
(作出猜想)
猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是______________ 。
(查阅资料)
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(设计与实验)
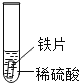
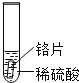
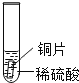
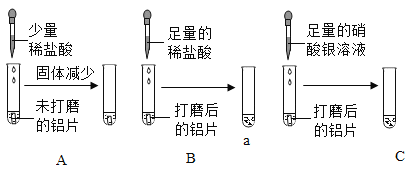
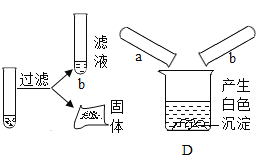
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
实验编号 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | ______________ |
(结论与解释)
(1)小聪得到的结论是猜想_________ 正确。
(2)实验前用砂纸打磨金属片的目的是___________________________________。
(知识运用)
将铬片投入FeSO4溶液中,反应__________(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式_____________________________________________ 。
【答案】Cu Fe>Cr>Cu 无明显现象 一 除去金属表面的氧化物及杂质 能 ![]()
【解析】
[知识回放]金属活性性顺序表为钾钙钠镁铝锌铁锡铅氢铜汞银铂金,所以缺少的是铜,化学式为Cu;
故答案为:Cu。
[作出猜想]铁、铬、铜三种金属金属活动性中,铁是强于铜的,所以猜想中主要是猜测铬与铁和铬与铜水的金属活动性强,因此除了上述猜想,还有猜想铁>铬>铜;
故答案为:Fe>Cr>Cu。
[设计与实验]铜的金属活动性弱于氢,所以不会与稀硫酸反应,因此不能观察实验现象;
故答案为:无明显现象。
[结论与解释](1)试管1放出气体的速率比试管2慢,所以可以得出铬的金属活动性强于铁,且两者都是强于氢,试管3中铜的金属活动性弱于氢,所以可以得出铬>铁>铜,所以猜想一正确;
故答案为:一。
(2)金属表面容易被氧化,与酸不能充分接触,所以需要打磨表面,去除表面的氧化物和其他杂质,利于与酸接触,观察实验现象;
故答案为:除去金属表面的氧化物及杂质。
[知识运用]从上述实验可以得出铬的金属活动性强与铁,所以铬可以与含有铁离子的盐溶液发生置换反应,得到金属铁,所以铬与硫酸亚铁可以反应;根据铬与稀硫酸反应的现象,可知铬发生置换反应时,生成硫酸亚铬,所以铬与硫酸亚铁反应生成硫酸亚铬和铁,所以化学方程式为![]() ;
;
故答案为:![]() 。
。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】如表各组中,实验操作和目的对应关系正确的是![]()
![]()
选项 | 实验操作 | 实验目的 |
A. | 硫在氧气中燃烧时,集气瓶底部放少量水 | 防止炸裂瓶底 |
B. | 实验室制取蒸馏水时,向水中加入碎瓷石 | 防止加热时出现暴沸 |
C. | 用双氧水制氧气时,加入少量二氧化锰 | 得到更多的氧气 |
D. | 将较浑浊的泥沙水进行过滤前,须先静置一会儿 | 过滤更充分 |
A.AB.BC.CD.D
【题目】小晨同学从课外读物中得知:在加热条件下,钠与CO2反应的产物可能有C、CO、Na2CO3、Na2O。于是设计实验对产物成分进行探究。
(查阅资料)①BaCl2溶液呈中性;②4Na+O2=2Na2O;③Na2O+H2O=2NaOH;④2Na+2H2O=2NaOH+H2↑;⑤CO通入PdCl2溶液中有黑色沉淀生成。
(提出问题)在加热条件下,钠与CO2反应的产物有哪些?
(猜想假设)猜想一:产物中一定有C 猜想二:产物中一定有CO
猜想三:产物中一定有Na2CO3 猜想四:产物中一定有Na2O
(实验验证)用下图所示装置(夹持装置已略去)进行实验探究。
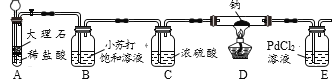
装置A中发生反应的化学方程式为_____;装置C的作用是_____。
序号 | 实验操作 | 实验现象 | 实验结论 |
(1) | 待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解 | 有黑色不溶物 | 猜想____正确 |
(2) | 将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液 | _____ | 猜想三正确 |
(3) | _____ | 猜想二正确 |
(反思与评价)小晨同学向实验(2)所得溶液中滴入几滴酚酞溶液,溶液呈红色。 于是得出结论:在加热条件下,钠与CO2反应一定产生Na2O。该结论是否严谨?____(填“是”或“否”),理由是____。