题目内容
【题目】为探究金属的化学性质,某化学探究小组进行如下实验活动。
[提出问题]铝具有什么化学性质?
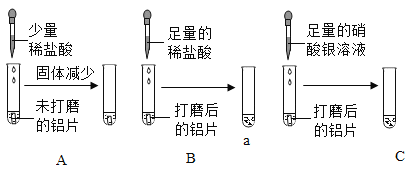
[实验探究1]小松和小雷分别用一片未打磨的铝片和打磨过的铝片进行实验A、B。实验B中观察到的现象是_____,得出铝与稀盐酸反应产生气体的结论。
[反思与评价]据现象小松认为铝与稀盐酸反应不产生气体,请评价小松的实验和结论______。经过思考,小松向试管中继续滴加足量的盐酸,一会儿后观察到和B中相同的现象,小松据此推测出铝具有的另一条化学性质是_____(用化学方程式表示)。
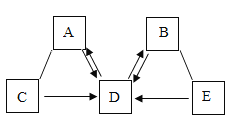
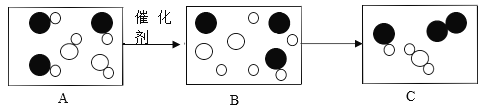
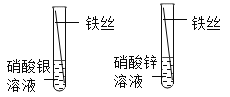
[实验探究2]小雷进行了如图C实验没有观察到明显现象,是否发生了化学反应呢?过滤后称量滤出的固体,发现固体质量增加,借助小松的实验得出的结论,小雷向滤出固体中加入足量稀盐酸,无明显现象,可知滤渣中不含_____,而是____。 据此可知C中发生反应的化学方程式为____________。于是又得出一条铝具有的化学性质。
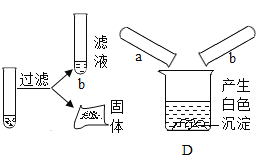
[发现新问题]同学们又对a、b中溶质的成分产生兴趣。
[实验探究]根据对溶质成分的猜想,结合实验探究I的探究成果,小松取少量a、b样品通过混合的方法鉴别a、b中溶质的成分。
[分析与结论]小雷对小松的实验提出质疑,他认为通过实验D,能推测b中溶质的成分,却无法确定a中溶质的成分。根据现象和实验事实,能推测出b中溶质含有的离子是____ ( 填离子符号)。无法确定a中溶质的成分是因为____。
[实验与结论]经过思考,为确定a中溶质,小组同学取少量a样品,加入___(填化合物)观察到明显现象,最终确定了a中溶质的成分。
[归纳与总结]通过上述实验可以总结出;在探究物质的性质时,我们要排除物质具有的性质和生成的物质对探究其他性质可能产生的干扰。
【答案】有气泡产生,固体逐渐消失 不正确,因为未打磨的铝片表面有氧化铝,少量的盐酸无法溶解完氧化铝 ![]() 铝 银
铝 银 ![]()
![]() 、
、![]() 、
、![]() D中产生白色沉淀可能是硝酸银与氯化铝反应生成的,无法证明a中是否含有盐酸 镁条
D中产生白色沉淀可能是硝酸银与氯化铝反应生成的,无法证明a中是否含有盐酸 镁条
【解析】
[实验探究1]
实验B中是铝和足量的盐酸反应,生成氯化铝和氢气,所以观察到铝逐渐消失,有气泡产生,得出铝与稀盐酸反应产生气体的结论。
[反思与评价]
小松的实验结论不正确,因为未打磨的铝片表面有氧化铝,少量的盐酸无法溶解完氧化铝。向试管中继续滴加足量的盐酸,一会儿后观察到和B中相同的现象,说明铝能与氧气反应生成氧化铝,反应方程式为![]() 。
。
[实验探究2]
向固体中加入足量稀盐酸,无明显现象,说明该固体不与盐酸反应,可知滤渣中不含铝,而是银。 可知C中是铝和硝酸银反应生成银和硝酸铝,反应的化学方程式为![]() 。
。
[分析与结论]
根据实验D有白色沉淀产生,说明是氯离子和银离子反应形成氯化银白色沉淀,则能推测b中溶质有剩余的硝酸银和生成的硝酸铝,所以b中溶质含有的离子是![]() 、
、![]() 、
、![]() 。a中溶质一定有氯化铝,氯化铝与硝酸银反应生成氯化银和硝酸铝,因此无法证明是a中溶质否含有盐酸,也就无法确定a中溶质的成分。
。a中溶质一定有氯化铝,氯化铝与硝酸银反应生成氯化银和硝酸铝,因此无法证明是a中溶质否含有盐酸,也就无法确定a中溶质的成分。
[实验与结论]
为确定a中溶质,取少量a样品,加入镁条,因为镁与盐酸反应生成氯化镁和氢气,观察到明显现象,最终确定了a中溶质的成分。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
(知识回放)
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)________Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。
(作出猜想)
猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是______________ 。
(查阅资料)
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(设计与实验)
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
实验编号 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | ______________ |
(结论与解释)
(1)小聪得到的结论是猜想_________ 正确。
(2)实验前用砂纸打磨金属片的目的是___________________________________。
(知识运用)
将铬片投入FeSO4溶液中,反应__________(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式_____________________________________________ 。