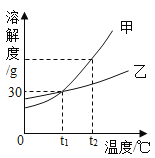
题目内容
【题目】有A、B、C、D、E、F、G七种物质。在常温下A是无色无味气体,它可以由一种紫黑色固体B加热分解制得,C在A中燃烧生成无色有刺激性气味的气体D,D能造成大气污染。E在A中燃烧发出白光,并生成一种能使澄清石灰水变浑浊的气体F。G在A中燃烧会火星四射。
(1)根据以上现象,写出这几种物质的名称:B.________,D.________,E.________,G.________。
(2)写出G在A中燃烧的文字表达式:__________。
(3)做C在A中燃烧的实验时,集气瓶中要留一层水,其作用是________。
【答案】高锰酸钾 二氧化硫 碳 铁 铁+氧气![]() 四氧化三铁 吸收有毒气体二氧化硫,防止污染空气
四氧化三铁 吸收有毒气体二氧化硫,防止污染空气
【解析】
在常温下A是无色无味气体,它可以由一种紫黑色固体B加热分解制得,紫黑色固体高锰酸钾加热产生氧气,则A是氧气;B是高猛酸钾;C在A中燃烧生成无色有刺激性气味的气体D,D能造成大气污染。硫在氧气中燃烧能产生二氧化硫,二氧化硫有毒,能污染空气,则C是硫、D是二氧化硫;E在A中燃烧发出白光,并生成一种能使澄清石灰水变浑浊的气体F。碳在氧气中燃烧能发出白光,产生二氧化碳气体,二氧化碳能是澄清的石灰水变浑浊,则E是碳,F是二氧化碳;G在A中燃烧会火星四射,铁丝在氧气中燃烧放出大量的热,火星四射;则G是铁。
(1)由分析可知,物质的名称:B.高猛酸钾,D.二氧化硫,E.碳,G.铁。
(2)铁在氧气中燃烧产生四氧化三铁的文字表达式:铁+氧气![]() 四氧化三铁。
四氧化三铁。
(3)做硫在氧气中燃烧的实验时,会产生有毒气体二氧化硫,二氧化硫易溶于水,集气瓶中要留一层水,其作用是:吸收有毒气体二氧化硫,防止污染空气。

【题目】化学实验是我们应用化学知识、拓展化学思维和培养化学素养的重要途经。如下图所示,在一只烧杯中进行实验,认真分析实验步骤,不能达到预期效果或目的的是( )
序号 | 目的 | 步骤 |
A | 探究盐酸能否与氢氧化钠发生反应 | ①加入NaOH溶液;②滴加酚酞溶液; ③加入适量盐酸 |
B | 检验NaCl中混有Na2CO3 | ①加入少量样品;②加入适量水至全部溶解;③加入适量氢氧化钙溶液 |
C | 验证KCl不能无限溶解 | 20℃时:①加入100g水;②加入15gKCl;③加入15gKCl。(已知:20℃时,KCl的溶解度为34g) |
D | 配制50g溶质质量分数为5%的氯化钠溶液 | ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解 |
A.AB.BC.CD.D
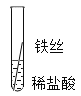
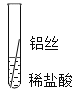
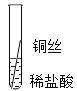
【题目】学习了金属的性质之后,同学们决定用实验对铁、铝、铜三种金属的活动性顺序进行验证.
![]() 实验一
实验一![]() 将粗细相同的铁丝、铝丝、铜丝分别插入相同的稀盐酸中:
将粗细相同的铁丝、铝丝、铜丝分别插入相同的稀盐酸中:
操作 |
|
|
|
片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 |
几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 |
![]() 讨论交流
讨论交流![]() 铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为 ______
铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为 ______ ![]() 做金属性质实验前需先将金属进行打磨,目的是 ______
做金属性质实验前需先将金属进行打磨,目的是 ______ ![]() 实验中用到的“相同”盐酸指的是 ______ 相同.
实验中用到的“相同”盐酸指的是 ______ 相同.
![]() 反思评价
反思评价![]() 若不认真分析现象可能导致错误的结论.
若不认真分析现象可能导致错误的结论.
![]() 实验二
实验二![]() 为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,欲通过实验现象得出金属活动性顺序.
为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,欲通过实验现象得出金属活动性顺序.
实验过程中能看到:硫酸铝溶液中的铁丝表面 ______ ,硫酸铜溶液中的铁丝表面 ______ ,反应的化学方程式 ______ .
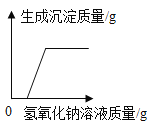
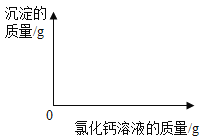
【题目】小明同学为了测定市面销售的某品牌纯碱中碳酸钠的质量分数(杂质为氯化钠,氯化钠溶于水且不与氯化钙反应),进行了如下实验:①在三个烧杯中分别加入11.0g 样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%的氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。实验所得数据见下表,请你分析并进行有关计算:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量/g | 55.5 | 120.0 | 150.0 |
白色固体的质量/g | 5.0 | 10.0 | 10.0 |
(1)在图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。______
(2)样品中碳酸钠的质量分数是_____?(结果精确到0.1%)
(3)烧杯Ⅱ所得溶液中氯化钠的溶质质量分数是_______?(结果精确到0.1%)