题目内容
【题目】学习了金属的性质之后,同学们决定用实验对铁、铝、铜三种金属的活动性顺序进行验证.
![]() 实验一
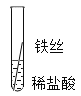
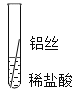
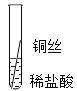
实验一![]() 将粗细相同的铁丝、铝丝、铜丝分别插入相同的稀盐酸中:
将粗细相同的铁丝、铝丝、铜丝分别插入相同的稀盐酸中:
操作 |
|
|
|
片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 |
几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 |
![]() 讨论交流
讨论交流![]() 铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为 ______
铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为 ______ ![]() 做金属性质实验前需先将金属进行打磨,目的是 ______
做金属性质实验前需先将金属进行打磨,目的是 ______ ![]() 实验中用到的“相同”盐酸指的是 ______ 相同.
实验中用到的“相同”盐酸指的是 ______ 相同.
![]() 反思评价
反思评价![]() 若不认真分析现象可能导致错误的结论.
若不认真分析现象可能导致错误的结论.
![]() 实验二
实验二![]() 为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,欲通过实验现象得出金属活动性顺序.
为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,欲通过实验现象得出金属活动性顺序.
实验过程中能看到:硫酸铝溶液中的铁丝表面 ______ ,硫酸铜溶液中的铁丝表面 ______ ,反应的化学方程式 ______ .
【答案】铝表面致密的氧化物薄膜会先与盐酸反应 除去金属表面的氧化物或锈(或污物) 浓度和体积 无现象 有红色金属出现 Fe+CuSO4=FeSO4+Cu
【解析】
[实验一]由于铝易与空气中的氧气反应,在其表面形成致密的氧化物薄膜。所以,铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为铝表面致密的氧化物薄膜会先与盐酸反应。做金属性质实验前需先将金属进行打磨,目的是除去金属表面的氧化物或锈(或污物)。由控制变量法探究物质的性质可知,实验中用到的“相同”盐酸指的是浓度和体积相同。故填:铝表面致密的氧化物薄膜会先于盐酸反应;除去金属表面的氧化物或锈(或污物);浓度和体积。
[实验二]由金属活动性顺序可知,金属的活动性顺是铝>铁>铜。所以,硫酸铝溶液中的铁丝表面无现象,硫酸铜溶液中的铁丝表面有红色金属出现,反应的化学方程式是:Fe+CuSO4=FeSO4+Cu。故填:无现象;有红色金属出现;Fe+CuSO4=FeSO4+Cu。