题目内容
【题目】某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如下图所示.则:
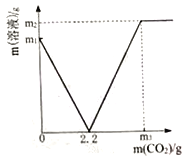
(l)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_______g;
(2) 4.0g样品中杂质CaCO3的质量为多少?(写出计算过程)
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为__________(精确到0.1%)。若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_______(填“有”、“没有”)影响。原因是________________。
【答案】(l)2.2g;(2) 0.3g(3)4.2%没有。未溶解的氢氧化钙也能与二氧化碳生成碳酸钙。
【解析】(l)由图可知以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为2.2g;
(2) 设4.0g样品中杂质CaCO3的质量为x
Ca(OH)2+CO2=CaCO3↓+H2O
74 44 100
X 2.2g y
74/x=44/2.2g x=3.7g 4.0g样品中杂质CaCO3的质量为4.0g-3.7g=0.3g
100/y=44/2.2g y=5g
(3)CaCO3↓+H2O+CO2= Ca(HCO3)2
100 44 162
5.3g m n
100/5.3g=44/m=162/n
M=2.332g n= 8.586g
8.586÷(4g+2.2g+2.332g+200g)×100%≈4.2%
若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果没有影响。原因是未溶解的氢氧化钙也能与二氧化碳生成碳酸钙。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】某同学进行下图两个实验。
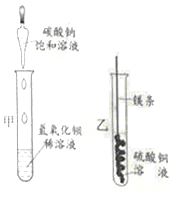
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。