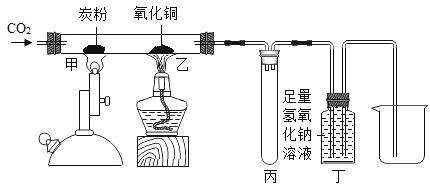
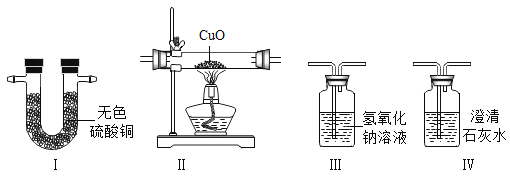
题目内容
【题目】如下图A是某粒子的结构示意图,B是铝元素周期表中的信息。
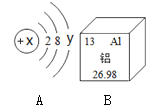
(1)若A粒子带有两个单位的负电荷,且y 等于8,则该粒子的符号为 ___________;
(2)当x=17时,A元素和B元素形成的化合物化学式为_______________;
(3)B元素的单质在空气中能生成致密的____________(化学式)薄膜;
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是______________(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43﹣和SO42﹣
【答案】S2- AlCl3 Al2O3 BD
【解析】
本题主要考查了原子结构示意图与离子结构示意图。
(1)已知该粒子带两个单位负电荷,且y=8,则知原子得2个电子,可知x的值为(2+8+8)-2=16,为硫元素,,根据离子的表示方法可表示为:S2-;
(2)当x=17时,A元素是氯元素,与金属形成化合物时显-1价,B是铝元素,化合价是+3价,化合物的化学式为AlCl3;
(3)B元素的单质是铝,在空气中与氧气反应能生成致密的氧化铝(Al2O3)薄膜;
(4)A、一个NO分子中有2个原子,7+8=15个电子;一个O2分子中有2个原子,8+8=16个电子,两种分子不是等电子体;
B、一个CO分子中有2个原子,6+8=14个电子;一个N2分子中有2个原子,7+7=14个电子,两种分子是等电子体;
C、一个SO2分子中有3个原子,16+8×2=32个电子;一个CO2分子中有3个原子,6+8×2=22个电子,两种分子不是等电子体;
D、一个PO43-离子中有5个原子,15+8×4+3=50个电子;一个SO42-离子中有5个原子,16+8×4+2=50个电子,两种离子是等电子体。故选BD。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
【题目】常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。右下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是

M | N | y | |
A | 水 | 氧化钙 | 溶液的温度 |
B | 水 | 氢氧化钠 | 溶液的pH |
C | 饱和氯化钠溶液 | 氯化钠 | 溶液的溶质质量分数 |
D | 硫酸铜溶液 | 铁粉 | 溶液的质量 |
【题目】甲乙丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸完全反应,所得数据如下表:
甲 | 乙 | 丙 | |
金属混合物的质量(g) | 10 | 10 | 20 |
稀硫酸的质量(g) | 100 | 120 | 100 |
反应后,过滤所得干燥固体的质量(g) | 4.4 | 4.4 | 14.4 |
请计算:
(1)_______中铁和稀硫酸恰好完全反应
(2)金属混合物中铁的质量分数为________。
(3)计算铁和稀硫酸恰好完全反应时生成物的溶液中溶质的质量分数(精确到0.1%)________。
【题目】常温下,下表物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | CaCO3 | Ca(OH)2 | CaCl2 |
|
B | CuO | H2O | O2 | |
C | NaCl | NaNO3 | NaOH | |
D | CO2 | H2O | H2CO3 |
A.AB.BC.CD.D