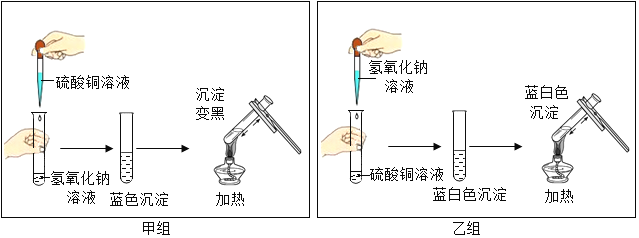
题目内容
【题目】下面是几种实验仪器.
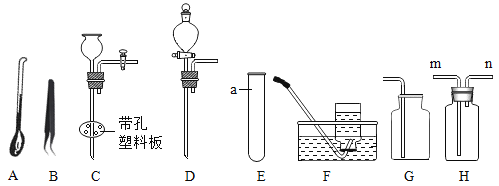
①仪器a的名称是____.
②实验室用二氧化锰与双氧水制取氧气,其发生装置的仪器组合是____(填编号).还可以用氯酸钾和二氧化锰制氧气,取用药品氯酸钾和二氧化锰的仪器是____(填编号),该反应的化学方程式为____.
③F装置收集氧气,操作的正确顺序为____(填编号).
a.将导管伸入集气瓶口
b.将装满水的集气瓶倒置在水槽中
c.用毛玻璃片盖上瓶口,将集气瓶移出水面放置
若用H装置进行排空气法收集氧气,气体应从____(填“m”或“n”)端通入.
【答案】试管 DE A 2KClO3![]() 2KCl+3O2↑ bac m
2KCl+3O2↑ bac m
【解析】
(1)试管是常用的反应容器,故答案为:试管;
(2)实验室用二氧化锰与双氧水制取氧气,其发生装置的仪器组合是DE,取用药品氯酸钾和二氧化锰的仪器是药匙,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;故答案为:DE;A;2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)F装置收集氧气,操作的正确顺序为:将装满水的集气瓶倒置在水槽中,将导管伸入集气瓶口,用毛玻璃片盖上瓶口,将集气瓶移出水面放置;若用H装置进行排空气法收集氧气,气体应从长管进入,因为氧气的密度比空气大;故答案为:bac;m;

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
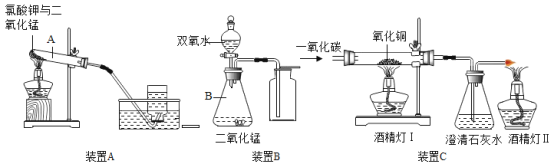
(问题讨论)用下图所示装置进行实验:
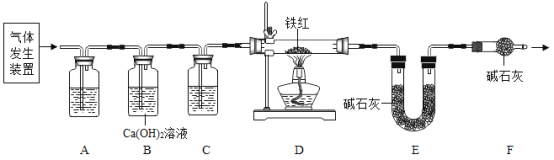
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_____(填字母编号)。
a 浓硫酸 b 澄清的石灰水 c 氢氧化钠溶液
(3)B装置的作用是________。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸。
②停止加热后_________。
(5)写出D装置中所发生反应的一个化学方程式____。
(数据分析与计算)
(资料2)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(6)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为mg。
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_____。
(实验评价)
本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会____(填“偏小”、“不变”或“偏大”)。
【题目】甲乙丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸完全反应,所得数据如下表:
甲 | 乙 | 丙 | |
金属混合物的质量(g) | 10 | 10 | 20 |
稀硫酸的质量(g) | 100 | 120 | 100 |
反应后,过滤所得干燥固体的质量(g) | 4.4 | 4.4 | 14.4 |
请计算:
(1)_______中铁和稀硫酸恰好完全反应
(2)金属混合物中铁的质量分数为________。
(3)计算铁和稀硫酸恰好完全反应时生成物的溶液中溶质的质量分数(精确到0.1%)________。
【题目】NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)10℃时,在100 g水里溶解_________g KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
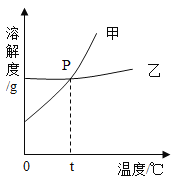
A.10℃~20℃ B.20℃~30℃
C.30℃~40℃ D.40℃~50℃
(3)10℃时,分别在100 g水中加入35 g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变