题目内容
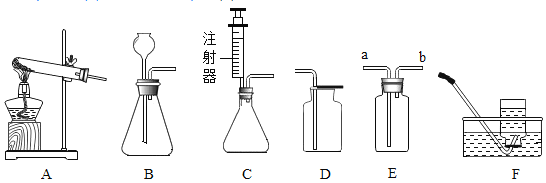
【题目】(7分)下列是小明同学配制100 g 10% NaCl溶液的实验操作示意图。
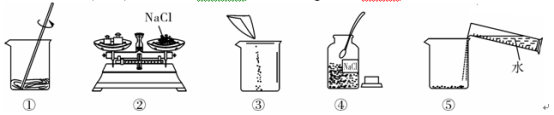
(1)该实验正确的操作顺序是____________(填序号)。
(2)认真观察指出图中错误的操作步骤________(填序号)。
(3)配制该溶液需要NaCl固体________g,需要水________mL(ρ水=1 g/mL)。
(4)小明同学将称量完毕的食盐转移到烧杯里时,不慎将少量食盐洒落在桌面上,这样会使所配制的溶液中溶质质量分数________10%(填“>”“=”或“<”)。
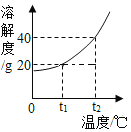
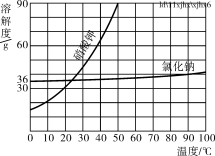
(5)部分物质溶解度曲![]() 线如右图所示,在20 ℃时,将40 g NaCl固体加入到100 g水中,搅拌使其充分溶解,你认为所得NaCl溶液的质量是________g,溶质质量分数是________%(精确到0.1%)。
线如右图所示,在20 ℃时,将40 g NaCl固体加入到100 g水中,搅拌使其充分溶解,你认为所得NaCl溶液的质量是________g,溶质质量分数是________%(精确到0.1%)。
【答案】(1)④②③⑤① (2)② (3)10 90 (4)< (5)136 26.5
【解析】(1)根据配制溶质质量分数一定的溶液的基本步骤考虑;(2)根据用天平称量物质的注意事项考虑;(3)溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量;(4)根据溶质质量分数的计算方法考虑;(5)根据溶解度考虑加入的溶质是否全部溶解再进行计算.
解:(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放;
(2)称量时左物右码,氯化钠不能直接放到托盘上;
(3)氯化钠质量:100g×10%=10g,需水:100g-10g=90g,水水体积:![]() =90mL;
=90mL;
(4)不慎将少量食盐洒落在桌面上,溶质少了,导致溶质质量分数小了;
(5)20℃时,NaCl溶解度为36g说明100g水中最多溶36g,所以溶液质量为36g+100g=136g,溶质质量分数为:![]() ×100%=26.5%
×100%=26.5%
故答案为:(1)④②③⑤①(2)②(3)10 90 (4)<(5)136 26.5

【题目】小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入烯盐酸的质量(克) | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
充分反应后剩余固体的质量(克) | 24.35 | 23.70 | 23.05 | 23.00 | 23.00 |
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是________克。
(2)所用稀盐酸中溶质的质量分数是多少________?
【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如表:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
下列说法正确的是( )
A.反应后X的质量为1.4g
B.X中一定含有碳元素和氢元素
C.X中一定含有碳元素和氧元素
D.X中两种元素的质量比为1:1