题目内容
某品牌补钙剂的主要成分是碳酸钙(杂质不含钙元素),向12g这种补钙剂样品中逐渐加入稀盐酸,盐酸质量和生成气体的质量如下表所示(杂质可溶于水,不和盐酸反应),第三次加入盐酸后,所得溶液中氯化钙的质量分数为20% 。求这份补钙剂含钙的质量分数。
| | 第一次 | 第二次 | 第三次 |
| 加入稀盐酸的质量 | 18.25g | 36.5g | 47.9g |
| 生成气体的质量 | 2.2g | 4.4g | 4.4g |
33.3%
第3次加入稀盐酸后生成气体的质量不再改变,说明生成气体的总质量是4.4g;然后根据化学方程式列比例,求解
方法一:
解:设样品中碳酸钙的质量为x
CaCO3 + 2HCl ="=" CaCl2 + H2O + CO2↑ …………………0.5分
100 44
X 4.4g …………………2.5分
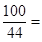
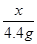
x = = 10g ……… …………3.5分
= 10g ……… …………3.5分
10g ×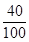 = 4g …………………4.5分
= 4g …………………4.5分
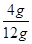 × 100% =33.3% …………………5.5分
× 100% =33.3% …………………5.5分
答:这份补钙剂含钙的质量分数为33.3% …………………6分
方法二:可根据二氧化碳质量求氯化钙质量,过程与方法一相似
方法三:
①根据质量守恒定律得出第三次加入盐酸后的溶液质量为55.5g ………2分
②氯化钙质量为55.5g × 20% = 11.1g ………………3分
③根据反应前后钙元素质量守恒,求出氯化钙中钙元素质量为4g …4分
④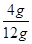 × 100% =33.3% …………………5分
× 100% =33.3% …………………5分
方法一:
解:设样品中碳酸钙的质量为x
CaCO3 + 2HCl ="=" CaCl2 + H2O + CO2↑ …………………0.5分
100 44
X 4.4g …………………2.5分
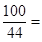
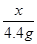
x =
 = 10g ……… …………3.5分
= 10g ……… …………3.5分10g ×
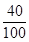 = 4g …………………4.5分
= 4g …………………4.5分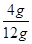 × 100% =33.3% …………………5.5分
× 100% =33.3% …………………5.5分答:这份补钙剂含钙的质量分数为33.3% …………………6分
方法二:可根据二氧化碳质量求氯化钙质量,过程与方法一相似
方法三:
①根据质量守恒定律得出第三次加入盐酸后的溶液质量为55.5g ………2分
②氯化钙质量为55.5g × 20% = 11.1g ………………3分
③根据反应前后钙元素质量守恒,求出氯化钙中钙元素质量为4g …4分
④
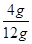 × 100% =33.3% …………………5分
× 100% =33.3% …………………5分
练习册系列答案
相关题目
 + C2H2↑。其中X是一种碱,则X的化学式为 ;
+ C2H2↑。其中X是一种碱,则X的化学式为 ;