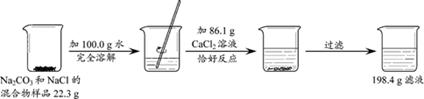
题目内容
(6分)某实验小组要测定混有氯化钠的纯碱样品中Na2CO3的质量分数。取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡,共消耗稀盐酸72.4g,测得反应后溶液的质量为80g。请帮助实验小组完成以下计算:
小题1:生成二氧化碳的质量。
小题2:反应后所得溶液中溶质的质量分数是多少?
小题1:生成二氧化碳的质量。
小题2:反应后所得溶液中溶质的质量分数是多少?
小题1: 12+72.4-80="4.4g"
小题1: 溶质的质量分数:16.375%
可以根据反应前后的质量差,就是二氧化碳的质量,(因为二氧化碳跑到空气中去了,所以质量会减少。)二氧化碳知道了,就可以求其他量了。
小题1:12+72.4-80=4.4g
小题1:设生成的氯化钠质量为X,原混合物中碳酸钠质量为y
Na2CO3 + 2HCl=2NaCl+ 2H2O + CO2
106 117 44
Y x 4.4g
117/44=x/4.4g, 106/44=Y/4.4g,
解得x=11.7,y=10.6
原混合物中氯化钠的质量为12-10.6=1.4g,
反应后所得溶液中溶质的质量分数是=(1.4g+11.7)/80*100%= 16.375%
小题1:12+72.4-80=4.4g
小题1:设生成的氯化钠质量为X,原混合物中碳酸钠质量为y
Na2CO3 + 2HCl=2NaCl+ 2H2O + CO2

106 117 44
Y x 4.4g
117/44=x/4.4g, 106/44=Y/4.4g,
解得x=11.7,y=10.6
原混合物中氯化钠的质量为12-10.6=1.4g,
反应后所得溶液中溶质的质量分数是=(1.4g+11.7)/80*100%= 16.375%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目