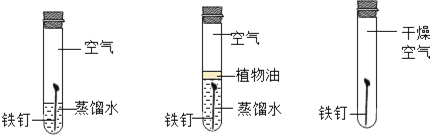
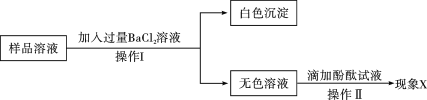
题目内容
【题目】如图是a、b两种固体物质(不含结晶水)的溶解度曲线,下列说法确的是

A. t1℃时,将a、b两物质的饱和溶液分别恒温蒸发等质量的水,析出的晶体的质量一定相等
B. t2℃时a溶液的质量分数一定小于b溶液的溶质质量分数
C. 若a中混有少量b,可以降温结晶的方法提纯a
D. 将t2℃时b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液
【答案】A
【解析】
A. 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t1℃时,a、b两物质的溶解度相同,将a、b两物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等,选项正确;
B. t2℃时a的溶解度比b的小,a的饱和溶液的质量分数一定小于b饱和溶液的溶质质量分数,不饱和时,溶质的质量分数大小关系不确定,选项错误;
C. a的溶解度受温度影响较小,若a中混有少量b,可以蒸发结晶的方法提纯a,选项错误;
D. b的溶解度随温度降低而减小,饱和溶液降温时会析出晶体得饱和溶液,将t2℃时b的不饱和溶液降温至t1℃,不一定能得到b的饱和溶液,选项错误。
故选A。

【题目】“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术,他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。”小颖看到这段话后非常感兴趣,她和同学们一起对该问题进行了一系列的探究。
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜 想]①可能有一种气体和另一种物质生成②反应过程中可能有能量变化
[设计装置]如图所示
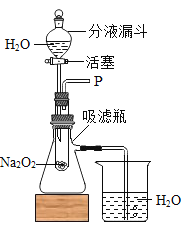
[实验探究]
实验一:探究反应后生成的气体是什么?
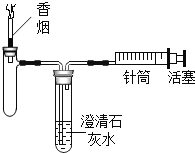
(1)打开上图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是________;
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:______________。
实验二:探究反应后生成的另一种物质是什么?
(1)小明猜想另一种物质是Na2CO3,小军认为不可能。为了证实小军的看法,请你设计一个证明Na2CO3不存在的实验:
实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | 生成物中没有 |
(2)小军取反应后所得的溶液于试管中,滴入无色酚酞溶液,发现试管中的溶液变成红色,说明反应后所得的溶液呈________性。
[表达]小军根据实验探究的结果,写出了过氧化钠和水反应的化学方程式为_________________。
【题目】某课外活动小组为测定某不纯锌粒中含锌的质量分数,取来20g锌粒样品,并取稀硫酸200g,平均分成4次加入锌粒样品中进行实验(杂质不与稀硫酸反应),结果如表:
实验 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 50 | 50 | 50 | 50 |
剩余固体的质量/g | 16.75 | 13.5 | 10.25 | 10 |
(1)样品中锌粒的质量分数是_____。
(2)所用稀硫酸溶质质量分数是_____(写出计算过程)。
【题目】某化学兴趣小组对酸、碱、盐的部分性质进行探究。
(探究一)氢氧化钠与二氧化碳反应
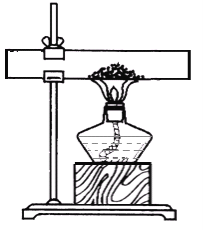
甲同学设计实验方案如图1所示
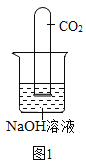
(1)实验现象为______,甲同学由此判断氢氧化钠和二氧化碳发生了反应。
(2)小组内其他同学认为甲同学方案不完善,理由是__。
(探究二)氢氧化钠和盐酸发生中和反应时放出热量。
乙同学向一定量10%的氢氧化钠溶液中滴加10%的盐酸,滴加过程中温度变化如表
加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
混合溶液温度 T/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(3)反应的化学方程式为___。
(4)根据表中数据分析混合溶液温度变化的原因___。
(5)小组内其他同学提出“将10%的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理并说明理由___。
(6)丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象。现将混合液中的氯化钠进行提纯,具体的操作为___。
(探究三)碳酸钠溶液与稀盐酸的分步反应
(查阅资料)向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,
第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应。
丁同学向一定量质量分数为10%的碳酸钠溶液中逐滴加入质量分数为3.65%的稀盐酸,生成二氧化碳的质量变化如图2所示(不考虑CO2的溶解)
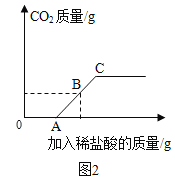
(7)写出OA段与A→C段发生反应的化学方程式:___、___。
(8)若A点横坐标为100,B点横坐标为150,则B点纵坐标为___。