题目内容
【题目】某课外活动小组为测定某不纯锌粒中含锌的质量分数,取来20g锌粒样品,并取稀硫酸200g,平均分成4次加入锌粒样品中进行实验(杂质不与稀硫酸反应),结果如表:
实验 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 50 | 50 | 50 | 50 |
剩余固体的质量/g | 16.75 | 13.5 | 10.25 | 10 |
(1)样品中锌粒的质量分数是_____。
(2)所用稀硫酸溶质质量分数是_____(写出计算过程)。
【答案】50% 9.8%
【解析】
解:前三次每次减少3.25g而第四次只减少了0.25g,说明剩余的10g固体为杂质,即锌的质量为20g﹣10g=10g。则样品中锌粒的质量分数为![]() ×100%=50%。
×100%=50%。
每50g稀硫酸与3.25g锌恰好完全反应。设所用稀硫酸溶质质量分数为x
Zn+H2SO4=ZnSO4+H2↑
65 98
3.25g 50gx
![]()
x=9.8%
答:(1)样品中锌粒的质量分数是 50%。
(2)所用稀硫酸溶质质量分数为9.8%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】某兴趣小组在实验室中探究氢氧化钾的性质,请你参与他们的探究。
(实验过程与分析)
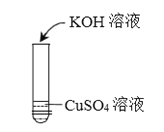
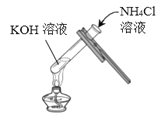
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | _______ | ______ | 无明显现象 |
实验结论 | 氢氧化钾能与硫酸铜发 生反应 | 氢氧化钾能与氯化铵发 生反应 | 氢氧化钾不能与硫酸 发生反应 |
(实验反思与拓展)
①某同学认为实验三的结论不正确。他改进了该实验方案,借助于酸碱指示剂,通过明显的现象证明氢氧化钾能与硫酸发生反应。简述他的实验方案:_____(写出操作方法和现象)。
②对于无明显现象的化学反应,可通过检验有新物质生成或检验_____的方法来证明物质间发生了化学反应。