题目内容
【题目】兴趣小组的同学为了研究(Cu﹣Zn合金)样品中铜的含量,取该样品20g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如下图所示.请计算:
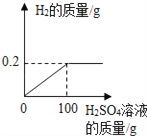
(1)反应的硫酸质量为多少g。
(2)求样品中铜的含量。
【答案】﹙1﹚9.8g;(2)67.5%
【解析】该样品20g跟足量的稀硫酸充分反应,产生氢气的质量为0.2g,
设20g该样品中锌的质量为x,参加反应硫酸的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
![]() ,
, ![]()
x=6.5g,y=9.8g
所以样品中铜的质量为:20g-6.5g=13.5g,样品中铜的含量![]() 100%=67.5%;
100%=67.5%;
答:(1) 反应的硫酸质量为:9.8g;(2) 样品中铜的含量为:67.5%。

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目

