题目内容
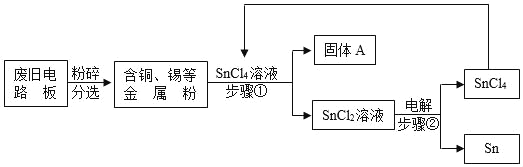
【题目】锶元素在元素周期表中显示的信息和粒子结构示意图如图所示。以下表述中正确的是( )
A. 图2、图3都属于锶元素
B. 图3所表示粒子的化学符号是Sr
C. 锶原子的中子数为38
D. 锶原子的相对原子质量是87.62g
【答案】A
【解析】
图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
粒子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数。当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子。
A、图2、图3的核内质子数均为38,均为锶元素,选项A正确;
B、图3所表示粒子质子数=38,核外电子数=36,质子数>核外电子数,为带2个单位正电荷的锶离子,其离子符号为Sr2+,选项B错误;
C、由锶元素元素周期表的每一格中各部分的意义可知,其核内质子数为38,不是中子数为38,选项C错误;
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,元素的相对原子质量为87.62,相对原子质量单位是“1”,不是“克”,选项D错误。故选A。

【题目】某化学小组同学对NaOH的化学性质进行如下实验探究。
实验一:NaOH溶液与CO2的反应,装置及实验测定结果如下
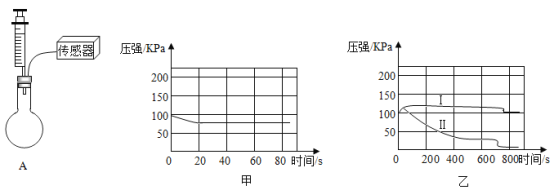
(1)某同学检验A装置气密性(夹持仪器省略),甲图象说明装置气密性良好,该同学进行的操作是_____。
(2)在烧瓶中充满CO2图乙是用注射器向瓶中分别注入同体积水和NaOH溶液得到的压强变化图象,其中表示CO2与NaOH溶液发生反应的是_____(填“Ⅰ”或“Ⅱ”),该反应的化学方程式为_____。
实验二:NaOH溶液与Fe2(SO4)3溶液的反应
(3)实验操作如图B所示,反应的化学方程式为_____。

(4)充分反应后得到的无色溶液中一定含有的离子是_____(填离子符号)。
实验三:NaOH溶液与盐酸的反应
室温下,取10份相同体积溶质质量分数为10%的NaOH溶液于10个烧杯中,分别滴加一定体积溶质质量分数为10%的盐酸,并测定溶液温度,记录数据如下:
加入盐酸体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
测得溶液温度 | 25.2 | 28.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
(5)加入盐酸体积在12﹣20mL之间时,溶液温度下降的原因可能是①_____②_____。
(6)根据碱与酸反应的性质,可将Al(OH)3制成抗胃酸(主要成分为HCl)药剂,请回答:
①Al(OH)3的相对分子质量_____。
p>②0.25g Al(OH)3能消耗胃酸中的HCl_____g(结果精确到0.01)