题目内容
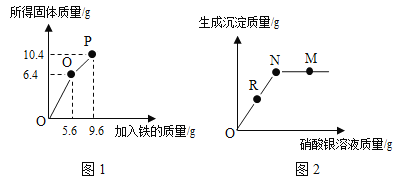
【题目】废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如图:
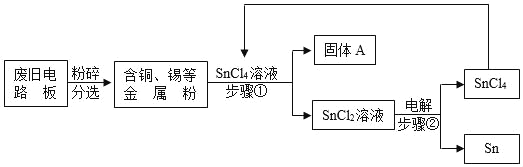
已知:Sn+SnCl4═2SnCl2
(1)SnCl4中若氯元素的化合价为﹣1价,则锡离子可表示为_____。
(2)铜的金属活动性比锡的_____(填“强”或“弱”),固体A中一定含有的金属元素是_____。
(3)写出步骤②发生反应的化学方程式_____;
(4)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是_____(回答一点即可)。
【答案】Sn 4+ 弱 铜  污染小
污染小
【解析】
根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
(1)SnCl4中若氯元素的化合价为﹣1价,则在该化合物中锡为+4价,对应的锡离子则带4个单位正电荷,所以可表示为Sn 4+;
(2)因为铜没有能和SnCl4反应生成锡单质,可见铜的金属活动性比锡的弱。由于铜没有出现在得到的溶液中,所以固体A中一定含有的金属元素是铜;
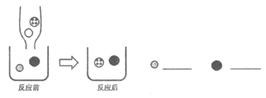
(3)步骤②发生反应是氯化亚锡在通电的条件下生成锌和氯化锡,所以对应的化学方程式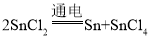 ;
;
(4)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是污染小。
故答案为:
(1)Sn 4+。(2)弱;铜。(3)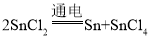 (4)污染小。
(4)污染小。

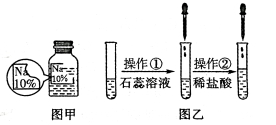
【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。