题目内容
【题目】某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系(如图所示)。下列说法不正确的是
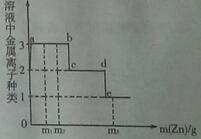
A.a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+
B.c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+
C.当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+
D.当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量
分数相等
【答案】D
【解析】
试题分析:根据金属活动性顺序可知:锌可先与硝酸银反应生成银和硝酸锌;然后再与硝酸铜反应生成铜和硝酸锌。A.a~b间发生的反应为锌与硝酸银的反应,b点为反应恰好完全发生。所以该段图像对应的溶液中金属离子为Zn2+、Ag+、Cu2+。此项正确。B.c~d间表示锌与硝酸铜反应,银离子已在b点完全反应,所以溶液中金属离子为Zn2+、Cu2+。此项正确。C.在d点铜离子已完全参与反应。所以当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+。此项正确。D.根据锌与硝酸银溶液反应的化学方程式可知:参加反应的锌的质量小于生成银的质量。即随着锌的反应,溶液的质量逐渐减小。当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数没有变化,但由于溶液溶液质量的减小。所以溶液中Cu(NO3)2的质量分数会随着参加反应的锌的质量的增大而增大。此项不正确。所以应选D项。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目