题目内容
【题目】某化学小组同学对NaOH的化学性质进行如下实验探究。
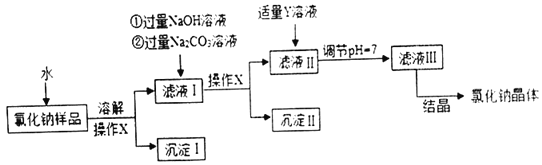
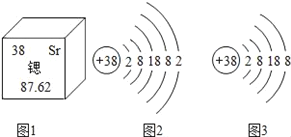
实验一:NaOH溶液与CO2的反应,装置及实验测定结果如下
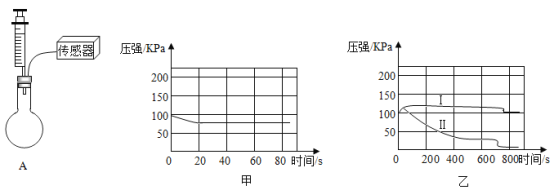
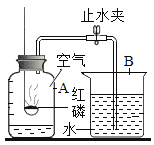
(1)某同学检验A装置气密性(夹持仪器省略),甲图象说明装置气密性良好,该同学进行的操作是_____。
(2)在烧瓶中充满CO2图乙是用注射器向瓶中分别注入同体积水和NaOH溶液得到的压强变化图象,其中表示CO2与NaOH溶液发生反应的是_____(填“Ⅰ”或“Ⅱ”),该反应的化学方程式为_____。
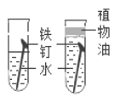
实验二:NaOH溶液与Fe2(SO4)3溶液的反应
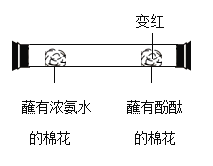
(3)实验操作如图B所示,反应的化学方程式为_____。

(4)充分反应后得到的无色溶液中一定含有的离子是_____(填离子符号)。
实验三:NaOH溶液与盐酸的反应
室温下,取10份相同体积溶质质量分数为10%的NaOH溶液于10个烧杯中,分别滴加一定体积溶质质量分数为10%的盐酸,并测定溶液温度,记录数据如下:
加入盐酸体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
测得溶液温度 | 25.2 | 28.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
(5)加入盐酸体积在12﹣20mL之间时,溶液温度下降的原因可能是①_____②_____。
(6)根据碱与酸反应的性质,可将Al(OH)3制成抗胃酸(主要成分为HCl)药剂,请回答:
①Al(OH)3的相对分子质量_____。
p>②0.25g Al(OH)3能消耗胃酸中的HCl_____g(结果精确到0.01)【答案】缓慢向外拉动注射器活塞,并保持活塞不动 Ⅱ 2NaOH+CO2=Na2CO3+H2O Fe2(SO4)3+3NaOH=Fe(OH)3↓+Na2SO4 Na+、SO42﹣ 反应停止,加入的过量盐酸使溶液的温度降低 反应结束后不再产生热量,自然冷却 78 0.35
【解析】
(1)甲图象说明装置气密性良好,该同学进行的操作是:缓慢向外拉动注射器活塞,并保持活塞不动;
(2)表示氢氧化钠与二氧化碳发生了化学反应的曲线是Ⅱ,因为二氧化碳与氢氧化钠反应后,压强几乎变为零;二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(3)硫酸铁和氢氧化钠反应生成氢氧化铁和硫酸钠,化学方程式为:Fe2(SO4)3+3NaOH=Fe(OH)3↓+Na2SO4;
(4)充分反应后得到的无色溶液中一定含有的离子是:Na+、SO42﹣;
(5)加入盐酸体积在12﹣20mL之间时,溶液温度下降的原因可能是:①反应停止,加入的过量盐酸使溶液的温度降低;②反应结束后不再产生热量,自然冷却;
(6)①Al(OH)3的相对分子质量=27+(16+1)×3=78;
②设能消耗HCl的质量为x,
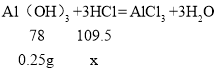
![]()
x≈0.35g。