��Ŀ����
����Ŀ��ij��ѧС���ͬѧ���� CuSO4��FeSO4 �Ļ����Һ��������̽��ʵ�顣
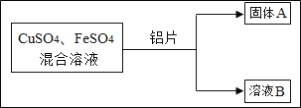
��1��д����������ͭ��Һ��Ӧ�Ļ�ѧ����ʽ_______________��
��2������� A �ϵμ�ϡ���ᣬ�������ݲ������� A ��һ�����еĹ�������Щ_____________��
�������ݲ���������Һ B ��һ�����е���������Щ___________________��
��3��ʵ��ʱ��ijͬѧ����Ƭ��������Һ�У�����һ����ɫ��ζ��������ġ��쳣��������������������Ϊ H2��CO2 �� SO2����ֱ�˵���������� CO2 �� SO2 ��ԭ��___________________��
���𰸡�2Al+3CuSO4=Al2(SO4)3+3CuCu �� FeFeSO4 �� Al2(SO4)3���������غ㶨�ɣ���Ӧ���о�����̼Ԫ�أ����������� CO2��SO2�д̼�����ζ��������������ɫ��ζ�ģ���Ҳ�������� SO2��
��������
��1����������ͭ��Ӧ������������ͭ����Ӧ����ʽΪ2Al+3CuSO4=Al2(SO4)3+3Cu��
��2�����������ã�����ͭ���ã��ʽ������뵽CuSO4��FeSO4��Һ�к�����������ͭ��Ӧ����������������Ӧ����Ӧ�������A�ϵμ�ϡ���ᣬ�������ݲ�����˵��һ��������ͭ���ڣ������������ڣ��������ݲ���˵�����������㣬��������ͭ��Ӧ������������ͭ������ͭ������ȫ��Ӧ�����ܲ��ַ�Ӧ����������û�вμӷ�Ӧ������Һ�е�����һ�������������������ɵ���������
��3�����������غ㶨�ɣ���Ӧ���о�����̼Ԫ�أ����������� CO2��SO2�д̼�����ζ��������������ɫ��ζ�ģ���Ҳ�������� SO2��

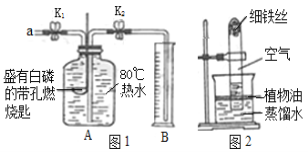
����Ŀ��ijͬѧ��������ͼ������ʵ�顣
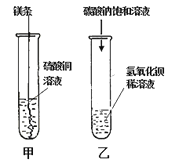
��l����ʵ��۲쵽��������________________����Һ����ɫ�����ɫ��
��2����ʵ���з�Ӧ�Ļ�ѧ����ʽΪ___________��
��3���Ѽס��ҷ�Ӧ�����Һ����ͬһ�ջ��������а�ɫ�������ɡ���������ɫ�����ijɷֽ���̽����
���������ϣ����ᱵ�������ᡣ
��������룩��ɫ����Ϊ����.________��.Mg(OH)��BaSO4����. Mg(OH)2��MgCO3.
��ʵ�鷽����
ʵ����� | ʵ����������� |
���ˡ�ϴ�Ӱ�ɫ�������ã����ɫ�����м������������� | �ٳ���ȫ���ܽ⣬���������������������仯 ѧ��Ӧ����ʽΪ ________________________�� ����_________________����������������������� ����������ȫ�ܽ⣬_______________������������ |
����չ��˼����������������������˽����ԭ��������ʵ��ʱ______________��
������ɫ�����ijɷֲ����ܳ��ֵ������Mg(OH)2��MgCO3��BaSO4��ԭ����________________��