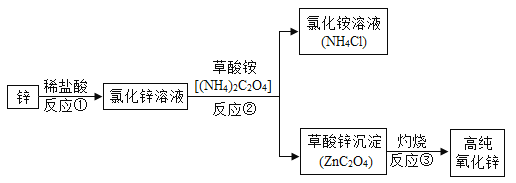
题目内容
【题目】某同学进行如下图的两个实验。
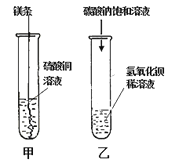
(l)甲实验观察到的现象是________________,溶液由蓝色变成无色。
(2)乙实验中反应的化学方程式为___________;
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(提出猜想)白色沉淀为:Ⅰ.________Ⅱ.Mg(OH)和BaSO4;Ⅲ. Mg(OH)2和MgCO3.
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化 学反应方程式为 ________________________。 ②若_________________且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,_______________,猜想Ⅲ成立。 |
(拓展与思考)如果猜想Ⅲ成立,产生此结果的原因是做乙实验时______________;
上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是________________。
【答案】镁条表面有红色物质析出;Na2CO3 + Ba(OH)2=== BaCO3↓+2NaOHMg(OH)2Mg(OH)2+2HCl===MgCl2+2H2O沉淀部分溶解有气体产生Na2CO3过量;Ba(OH)2和Na2CO3不可能同时剩余
【解析】
(1)镁能和硫酸铜反应生成铜和硫酸镁,故镁条表面有红色物质析出,溶液由蓝色变为无色;
(2)碳酸钠和氢氧化钡反应生成碳酸钡白色沉淀和氢氧化钠,其化学方程式为Na2CO3 + Ba(OH)2=== BaCO3↓+2NaOH;
提出猜想:根据实验结论①沉淀全部溶解,且无其它现象,猜想Ⅰ成立,可知沉淀为氢氧化镁,化学式为Mg(OH)2;
实验方案:
①氢氧化镁能溶于盐酸生成氯化镁和水,其化学方程式为Mg(OH)2+2HCl===MgCl2+2H2O;
②硫酸钡不溶于酸,若猜想二成立则沉淀部分溶解,且无气体产生;
③碳酸镁能和盐酸反应生成氯化镁、水和二氧化碳,若猜想三成立,则沉淀完全溶解且有气体产生;
拓展与思考:如果猜想Ⅲ成立,产生此结果的原因是做乙实验时碳酸钠溶液过量;若白色沉淀的成分是Mg(OH)2、MgCO3和BaSO4,则要求Ba(OH)2和Na2CO3均有剩余,但是钡离子和碳酸根离子会结合生成碳酸钡白色沉淀,故Ba(OH)2和Na2CO3不可能同时剩余,因此,白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】氧气是我们身边无法离开的物质。某兴趣小组对氧气的研究如下:
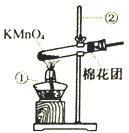
I.氧气的制备:
(1)写出上图中有标号仪器的名称:①___________,②__________。
(2)写出用KMnO4制取O2的化学反应方程式__________________。该装置中棉花团的作用是_______,图中装置一处明显的错误是______________。
II.氧气的收集:
[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | ||||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 | |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | |||||||
数据
(3)由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是_________。
(4)不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是_______。
Ⅲ.铁丝在氧气中燃烧
(5)铁丝在纯净氧气中燃烧的化学反应方程式为________________________。
(6)铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是_____________(填化学反应文字表达式)。