题目内容
在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物M,在一定条件下充分反应,测得反应前后各物质的质量如下:
| 物质 | 氧气 | 二氧化碳 | 水蒸气 | M |
| 反应前质量/g | 100 | 1 | 1 | 46 |
| 反应后质量/g | 4 | 89 | 55 | x |
(2)未知物M中一定含有的元素为(填元素符号)________.
(3)已知未知物M的相对分子质量为46,推出其化学式为________.
(4)该反应的化学方程式为________.
解:根据质量守恒定律,由表中数据可知:
二氧化碳的质量增加了89g-1g=88g,可确定二氧化碳是生成物;
水蒸气的质量增加了55g-1g=54g,可确定水蒸气是生成物;
氧气的质量减少了100g-4g=96g<88g+54g,可确定氧气和M都是反应物.
(1)M减少的质量为:88g+54g-96g=46g,因此X的值为:46-46=0.
(2)因反应物中的氧气里只含氧元素,因此生成物中的碳元素和氢元素一定来自M,即M中一定含有碳、氢两元素;
生成物中氧元素的质量为88g×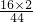 +54g×
+54g×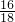 =112g>96g,可确定生成物中的一部分氧元素来自M,即M中一定含有氧元素.
=112g>96g,可确定生成物中的一部分氧元素来自M,即M中一定含有氧元素.
(3)M中碳、氢、氧三元素的原子个数比为 :
: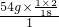 :
: =2:6:1,故M的化学式为C2H6O;
=2:6:1,故M的化学式为C2H6O;
(4)该反应的化学方程式为C2H6O+3O2 2CO2+3H2O.
2CO2+3H2O.
故答案为:(1)O;(2)C、H、O;(3)C2H6O;(4)C2H6O+3O2 2CO2+3H2O.
2CO2+3H2O.
分析:(1)根据质量守恒定律,由物质质量的增减量可确定反应物和生成物的质量,从而得出X的值;
(2)根据物质的化学式和物质的质量可确定物质的元素组成;
(3)根据物质中元素的质量可确定构成物质的原子个数比,从而得到物质的化学式;
(4)根据化学方程式的书写步骤可写出该反应的化学方程式.
点评:本题考查了质量守恒定律、有关元素质量分数的计算、根据物质的元素组成和质量确定物质的化学式、化学方程式的书写等知识,知识点较多,难度稍大.解答时必须要审好题,理清思路,细心答题,避免出错.
二氧化碳的质量增加了89g-1g=88g,可确定二氧化碳是生成物;
水蒸气的质量增加了55g-1g=54g,可确定水蒸气是生成物;
氧气的质量减少了100g-4g=96g<88g+54g,可确定氧气和M都是反应物.
(1)M减少的质量为:88g+54g-96g=46g,因此X的值为:46-46=0.
(2)因反应物中的氧气里只含氧元素,因此生成物中的碳元素和氢元素一定来自M,即M中一定含有碳、氢两元素;
生成物中氧元素的质量为88g×
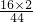 +54g×
+54g×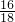 =112g>96g,可确定生成物中的一部分氧元素来自M,即M中一定含有氧元素.
=112g>96g,可确定生成物中的一部分氧元素来自M,即M中一定含有氧元素.(3)M中碳、氢、氧三元素的原子个数比为
 :
: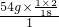 :
: =2:6:1,故M的化学式为C2H6O;
=2:6:1,故M的化学式为C2H6O;(4)该反应的化学方程式为C2H6O+3O2
 2CO2+3H2O.
2CO2+3H2O.故答案为:(1)O;(2)C、H、O;(3)C2H6O;(4)C2H6O+3O2
 2CO2+3H2O.
2CO2+3H2O.分析:(1)根据质量守恒定律,由物质质量的增减量可确定反应物和生成物的质量,从而得出X的值;
(2)根据物质的化学式和物质的质量可确定物质的元素组成;
(3)根据物质中元素的质量可确定构成物质的原子个数比,从而得到物质的化学式;
(4)根据化学方程式的书写步骤可写出该反应的化学方程式.
点评:本题考查了质量守恒定律、有关元素质量分数的计算、根据物质的元素组成和质量确定物质的化学式、化学方程式的书写等知识,知识点较多,难度稍大.解答时必须要审好题,理清思路,细心答题,避免出错.

练习册系列答案
相关题目
在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物M,在一定条件下充分反应,测得反应前后各物质的质量如下:
(1)根据质量守恒定律,你认为X的值应为 .
(2)未知物M中一定含有的元素为(填元素符号) .
(3)已知未知物M的相对分子质量为46,推出其化学式为 .
(4)该反应的化学方程式为 .
| 物质 | 氧气 | 二氧化碳 | 水蒸气 | M |
| 反应前质量/g | 100 | 1 | 1 | 46 |
| 反应后质量/g | 4 | 89 | 55 | x |
(2)未知物M中一定含有的元素为(填元素符号)
(3)已知未知物M的相对分子质量为46,推出其化学式为
(4)该反应的化学方程式为
已知W和氧气在一定条件下充分反应生成二氧化碳和水,在一密闭容器内有氧气、二氧化碳、水蒸气和一种可燃物W,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )
| 物 质 | 氧 气 | 二氧化碳 | 水蒸气 | W |
| 反应前质量/g | 50 | 1 | 1 | 23 |
| 反应后质量/g | 2 | Y | 28 | x |
| A、物质W含碳、氢和氧三种元素 |
| B、反应一定是氧化反应 |
| C、物质W只含碳和氢两种元素 |
| D、Y的值为45 |
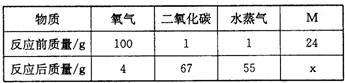 17、在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应.测得反应前后各物质的质量如表:
17、在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应.测得反应前后各物质的质量如表: