题目内容
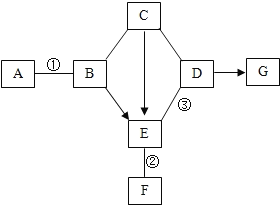
【题目】下图中的物质为初中化学常见物质,它们之间的反应关系如图所示(“→”表示转化关系,“-”表示相互能反应,部分反应物、生成物或反应条件已略去)。甲与A溶液反应得到浅绿色溶液;A、B发生中和反应,产物之一是厨房内常用的调味品;C常用于改良酸性土壤,且C的溶液与D的溶液反应可得到B;C与乙混合可配制波尔多液;乙与丙两种溶液反应生成两种不同颜色的沉淀。请回答:

(1)物质丙的化学式是_____;
(2)欲通过一步实验证明A、B是否恰好完全反应,需要向A、B反应后的溶液中加入的试剂是_____;
(3)E→C反应的化学方程式是_____;
(4)甲和乙反应的化学方程式是_____。
【答案】![]() 酚酞溶液
酚酞溶液 ![]()
![]()
【解析】
根据图中的物质为初中化学常见物质,甲与A溶液反应得到浅绿色溶液,说明生成亚铁离子;A、B发生中和反应,产物之一是厨房内常用的调味品,说明生成氯化钠;C常用于改良酸性土壤,且C的溶液与D的溶液反应可得到B,所以C为氢氧化钙,D为碳酸钠溶液,B为氢氧化钠溶液;C的溶液与乙的溶液反应,乙与丙两种溶液反应生成两种不同颜色的沉淀,说明乙、丙分别可能为硫酸铜、氢氧化钡溶液;结合图框,推测甲可能为铁,E可能为水,A可能为稀盐酸,然后将推出的物质进行验证即可。
(1)图中的物质为初中化学常见物质,甲与A溶液反应得到浅绿色溶液,说明生成亚铁离子;A、B发生中和反应,产物之一是厨房内常用的调味品,说明生成氯化钠;C常用于改良酸性土壤,且C的溶液与D的溶液反应可得到B,所以C为氢氧化钙,D为碳酸钠溶液,B为氢氧化钠溶液;C的溶液与乙的溶液反应生成蓝色沉淀,所以蓝色溶液为氢氧化铜;乙与丙两种溶液反应生成两种不同颜色的沉淀,说明乙、丙分别可能为硫酸铜、氢氧化钡溶液;结合图框,推测甲可能为铁,E可能为水,A可能为稀盐酸,经过验证,推导正确,所以物质丙的化学式是![]() ;
;
(2)欲通过一步实验证明A、B是否恰好完全反应,需要向A、B反应后的溶液中加入的试剂是:酚酞溶液;
(3)E→C的反应是氧化钙和水反应生成氢氧化钙,化学方程式是:![]() ;
;
(4)甲和乙的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式是:![]() 。
。

【题目】化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
知识回顾:在打开浓盐酸时常会看到瓶口有_____的现象,浓盐酸具有挥发性,导致这瓶盐酸溶液的质量分数变_____(填“大”、“小”)。
(实验探究Ⅰ)探究这瓶盐酸的化学性质
(1)请从下列试剂中选择试剂进行检验盐酸的化学性质,填写实验报告:
供选择试剂:紫色石蕊试液、酚酞试液、锌粒、铜片、氧化铜、氢氧化钠溶液、硫酸铜溶液
实验步骤 | 预计实验现象 |
取少量溶液于试管中,滴加_____ | 溶液变红色 |
另取少量溶液于试管中加入_____ | 有气泡产生 |
(实验探究Ⅱ)测定这瓶盐酸溶液中溶质的质量分数
(查阅资料)HCl+AgNO3═AgCl↓+2HNO3
(设计实验)小组同学设计了如下两套方案,请协助他们完成实验方案的设计。
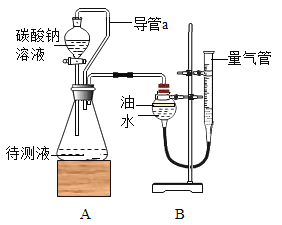
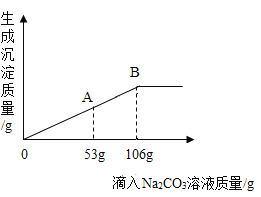
方案Ⅰ往盐酸中加入碳酸钠溶液反应产生气体,通过产生气体的量进行计算。取20mL的盐酸于锥形瓶中,加入足量的碳酸钠溶液并用如图所示装置进行实验:(假设该实验温度下,盐酸的密度均为1g/mL,二氧化碳的密度为2g/L)
(2)实验装置A中发生反应的化学方程式为_____。
(3)实验过程中,当观察到_____,说明加入的碳酸钠已经足量了。
(4)实验前量气管中水的体积为2.0mL,实验结束后量气管中水的体积为222.0mL,则生成二氧化碳的体积是_____mL。
(5)同学经过交流讨论后认为还必须考虑装置A和装置B内原有的气体.你认为装置A和装置B内原有的气体对实验的结果_____(填“有”或“没有”)影响。方案Ⅱ盐酸中加入硝酸银溶液反应产生沉淀,通过产生沉淀的量进行计算。于是同学们另取一定量的盐酸,按如下流程进行探究:
![]()
(6)产生的白色沉淀物质是_____。
【题目】熟石灰在部分温度下的溶解度如下表所示。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 |
①20℃时,0.56 g氧化钙放入到盛有100 g水的烧杯中。恢复到20℃时,所得溶液中水的质量_____(填“增大”、“减小”或“不变”),溶液中溶质的质量分数是 _____(写计算式)。
②采用一种操作方法,将上述烧杯中剩余固体全部溶解,变为不饱和溶液。下列说法正确的是 ____。
A 溶液的质量可能不变 B 溶液中溶质的质量分数一定减小
C 溶液中溶质的质量一定增大 D 可以升温使之变成不饱和溶液
【题目】实验室里有一瓶标签破损的硫酸,为测定其实际的溶质质量分数,小明同学在烧杯中加入50g稀硫酸,然后向烧杯内滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的加入,溶液的pH变化情况如下表所示:
氢氧化钠溶液的质量/g | 溶液的pH | 溶液中的溶质 |
30 | pH<7 | a |
40 | pH=7 | b |
50 | pH>7 | c |
分析并计算:
(1)溶液中的溶质含有2种阴离子的是 ________(从abc中选)。
(2)计算硫酸溶液中溶质的质量分数________ (结果精确到0.1%)。