题目内容
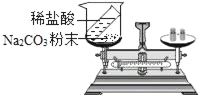
【题目】实验室里有一瓶标签破损的硫酸,为测定其实际的溶质质量分数,小明同学在烧杯中加入50g稀硫酸,然后向烧杯内滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的加入,溶液的pH变化情况如下表所示:
氢氧化钠溶液的质量/g | 溶液的pH | 溶液中的溶质 |
30 | pH<7 | a |
40 | pH=7 | b |
50 | pH>7 | c |
分析并计算:
(1)溶液中的溶质含有2种阴离子的是 ________(从abc中选)。
(2)计算硫酸溶液中溶质的质量分数________ (结果精确到0.1%)。
【答案】c 9.8%
【解析】
(1)氢氧化钠和硫酸反应生成硫酸钠和水,所以pH>7时氢氧化钠过量,溶液中的溶质含有2种阴离子的是c。
(2)设该瓶硫酸溶液的溶质质量分数是为x,则
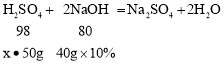
![]()
解得x=9.8%。
故答案为:(1)c;(2)该瓶硫酸溶液的溶质质量分数是9.8%。

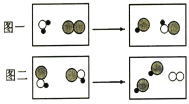
【题目】化学课学堂上要学习碱的性质,老师让两位同学和他共同实验,要求两位同学分别向澄清的石灰水和氢氧化钠的溶液里吹气,如图①②所示,老师告诉同学们,呼出的气体中只有二氧化碳能和氢氧化钠溶液和澄清的石灰水反应.
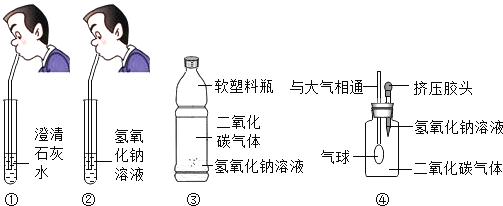
(1)同学们在吹气后观察到①中澄清石灰水边浑浊,②中氢氧化钠溶液无明显现象.观察实验现象后老师问,通过实验现象的观察,检验二氧化碳气体应该使用_____,原理是_____(用化学反应方程式表示).
(2)小明设计了如图所示的③、④两个实验.实验现象:③中的软塑料瓶变瘪,④中_____.
(3)小亮认为小明的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低,小光同学却对此提出了质疑,他认为小明的实验不严谨,原因是_____.若仍利用该装置,需要补做的对比实验是_____.
(4)小光设计的是通过检验生成物来验证猜想,请帮他填写实验报告:
实验步骤 | 实验现象 | 实验结论 |
取(3)实验后的溶液少许,再向其中加_____ | _____ | 验证了二氧化碳和氢氧化钠溶液反应 |
(5)(实验结论)二氧化碳和氢氧化钠溶液发生了化学反应.(反思拓展)探究结束老师说,通过此探究实验我们发现,对于没有明显现象的化学反应,可以从不同的角度证明反应的发生,这些角度可以是:
①通过_____证明反应发生;②通过_____证明反应的发生.
(6)(应用)通过反应可以知道氢氧化钠要密封保存,若一瓶氢氧化钠长期敞口放置,其中碳酸钠的质量分数为A,则氢氧化钠的质量分数为_____1﹣A(填大于、小于或等于),若要证明氢氧化钠是部分变质,先加入_____,①硝酸钙②氢氧化钙③硝酸钡④氢氧化钡(填写序号),出现沉淀,再加入酚酞溶液变红即可.