题目内容
【题目】将宏观、微观和化学用语、化学实验联系在一起是化学学科的特点。
(1)A、B、C、D表示四种物质,其微观示意图如图1所示:
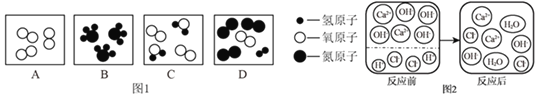
①从微观角度看,B图表示3个______(写化学式)。
②从宏观角度看,图1中表示单质的是______(填字母)
(2)图2表示的是向滴有紫色石蕊的稀盐酸中加入氢氧化钙溶液。据图分析可知,溶液颜色最终呈______,从微观角度分析,该反应的实质是______。
(3)1-18号元素原子最外层电子数与原子序数的关系如图3.试回答:
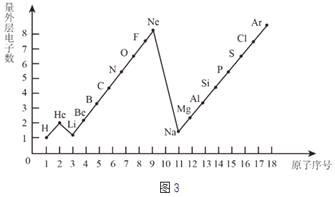
①1个二氧化碳分子共有______个原子核、______个质子。
②1个Al3+核外共有______电子;与Cl-的最外层电子数相同的原子是______。
【答案】NH3 A 蓝色 盐酸电离出的H+和氢氧化钙电离出的OH-结合成H2O分子。(H++OH-=H2O) 3 22 10 Ar
【解析】
(1)根据物质的微观构成,分析物质微粒的构成及物质的类别;
(2)对比反应前后的微粒变化,图2前后钙离子和氯离子没变说明该微粒实际没有参与反应,氢离子和氢氧改变了,反应后为水,说明生成了该新物质,即反应是氢离子和氢氧根离子反应生成水的过程。
(3)根据二氧化碳分子的构成进行解答;根据已有的原子的结构结合图示进行分析解答即可。
(1)①B图的每个分子是由1个氮原子和3个氢原子构成的,故填:NH3;
②由A、B、C、D表示四种物质的微观示意图可知,在C、D中都是由不同种分子构成的物质,从宏观上是由不同种物质组成的,属于混合物;在A中,是由同种原子构成的双原子分子构成的,宏观上是由同种元素组成的纯净物,属于单质。故填:A;
(2)图2反应后的微观示意图分析可知,溶液存在氢氧根离子,说明反应物中Ca(OH)2过量,颜色最终呈蓝色;
图3反应的微观本质是:盐酸电离出的H+和氢氧化钙电离出的OH-结合成H2O分子。
(3)①一个二氧化碳分子是由一个碳原子和二个氧原子构成,所以一个二氧化碳分子共有3个原子核;一个碳原子中含有6个质子,一个氧原子中含有8个质子,所以一个二氧化碳分子共有22个质子;
②一个一个Al原子的核外有13个电子,失去3个电子形成铝离子,一个Al3+核外共有13-3=10个电子,氯原子的核外电子数是17,得到一个电子形成氯离子,其核外电子数是17+1=18,与氩原子的核外电子数相同,故填:10,Ar。

【题目】根据下表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 |
NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)40℃时,100g水中最多溶解NH4Cl______g。
(2)若要从60℃时的饱和NaCl溶液中得到NaCl晶体,采用的方法是_______________。
(3)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。
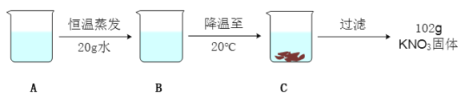
①A溶液为__________(填“饱和”或“不饱和”)溶液。
②对以下过程的分析,正确的是______(填编号)。
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等222g
d.开始析出KNO3固体的温度在60℃至80℃之间
【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
[提出问题]瓶口白色固体的成分是什么?
[查找资料]①玻璃中含有二氧化硅(SiO2),试剂瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来;
②二氧化硅能与氢氧化钠溶液反应, ![]() ;
;
③硅酸钠(Na2SiO3)是种白色固体,有很强的粘合性,可溶于水,溶液呈碱性;硅酸钠溶液能与强酸反应,如:![]() ;硅酸钠溶液能与氯化钙溶液反应:
;硅酸钠溶液能与氯化钙溶液反应:![]() 。
。
[作出猜想]白色固体的成分是:Ⅰ.硅酸钠; Ⅱ.硅酸钠和碳酸钠; Ⅲ.硅酸钠、碳酸钠和氢氧化钠
[实验探究]取一定量白色固体溶于适量水中形成样品溶液,分组进行如下实验并相互评价:
实验操作 | 实验现象 | 结论与评价 | ||
第 1 组 |
滴加足量_______ | 有气泡冒出,且产生白色沉淀 | 同学们认为猜想I______(成立或不成立);写出生成气体的化学方程式_______ | |
第 2 组 | 第一步 |
| 产生白色沉淀 | 第1组同学认为:此步骤还不能准确判断出原固体的成分 |
第二步 |
| ________ | 大家一致认为:猜想Ⅱ成立 | |
[反思交流]
(1)第2组实验第一步中加入过量氯化钙的作用是____________________________。
(2)有同学认为,第2组实验中不能用氢氧化钙溶液代替氯化钙落液,理由是______________________。
(3)氢氧化钠溶液必须密封保存,且试剂瓶只能用_____________塞。
【题目】实验室用如图装置制取、干燥、收集气体正确的是( )
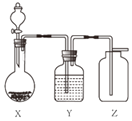
A | B | C | D | |
X | 过氧化氢溶液与 二氧化锰 | 锌粒与 稀硫酸 | 大理石与 稀盐酸 | 氯酸钾与 二氧化锰 |
Y | 浓硫酸 | 浓硫酸 | 氢氧化钠 | 浓硫酸 |
Z | O2 | H2 | CO2 | O2 |
A.AB.BC.CD.D
【题目】2019 年 3 月 22 日是第二十七届“世界水日”。
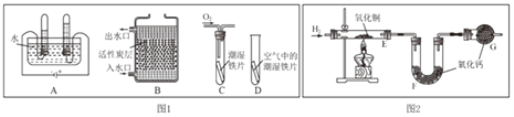
(1)根据图 1 回答下列问题。
①A 图所示的是电解水实验,写出该反应的化学方程式______;
②B 图所示的是活性炭净水器的示意图,其中活性炭的作用是______。
③C、D 图所示的是探究铁生锈条件的实验,一段时间后发现 C 中铁片变红,D 中铁片依 然光亮,对比 C、D 中的现象,说明影响铁生锈快慢的一个重要因素是______。
(2)若用质量分数为 10%的氢氧化钠溶液(密度为 1.1g/cm3)配制 220g 质量分数为 5%的 氢氧化钠溶液。
①需要 10%的氢氧化钠溶液体积为______mL。
②实验室配制该溶液的主要步骤有:计算、量取、______、装瓶并贴上标签。
③若量取氢氧化钠溶液读数时仰视,而其余操作均正确,这样配得的溶液的溶质质量分数 会______(填“偏高”、“偏低”或“无影响”)。
(3)根据上图 2 实验装置测定水的组成。 反应前后测得的 E、F 装置质量数据见表。
装置 E | 装置 F | |
反应前的质量/g | 38.2 | 212.4 |
反应后的质量/g | a | 214.2 |
①若测定水中氢、氧元素的质量比符合理论值,则表中 a 的数值是______。
②下列因素中,对测定结果有影响的是______(填字母)。
ACuO 粉末不干燥 BCuO 没有完全转化为 Cu C没有 G 装置