题目内容
【题目】根据下表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 |
NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)40℃时,100g水中最多溶解NH4Cl______g。
(2)若要从60℃时的饱和NaCl溶液中得到NaCl晶体,采用的方法是_______________。
(3)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。
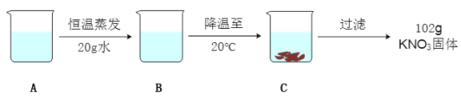
①A溶液为__________(填“饱和”或“不饱和”)溶液。
②对以下过程的分析,正确的是______(填编号)。
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等222g
d.开始析出KNO3固体的温度在60℃至80℃之间
【答案】45.8蒸发溶剂不饱和ac
【解析】
(1)查表可知,40℃时氯化氨的溶解度为45.8g,故40℃时,100g水中最多溶解NH4Cl45.8g。
(2)氯化钠的溶解度随温度的变化不大,故不能采用降温结晶的方法析出氯化钠,故只能选蒸发溶剂。
(3)①80℃时,硝酸钾的溶解度是169g,含义是80℃时,100g的水中最多能溶解169g的硝酸钾,故120g的水中最多能溶解硝酸钾的质量为120g×![]() =202.8g,故A溶液是不饱和溶液。
=202.8g,故A溶液是不饱和溶液。
②a.恒温蒸发20g的水后,溶解的质量变为100g,溶液中溶质的质量为102g,故溶液仍然为不饱和溶液,故A到B的过程中,溶质质量没有改变,故正确;
b. 恒温蒸发20g的水后,溶解的质量变为100g,溶液中溶质的质量为102g,故B中溶质与溶剂的质量比为102:100,故错误;
c.A溶液中水的质量为120g,溶质的质量为102g ,故溶液的质量等222g,故正确;
d.120g的水中溶解102g的硝酸钾,则该温度下100g 的水中溶解硝酸钾的质量为85g,故开始析出KNO3固体的温度在小于50℃,故错误。故选ac。

【题目】某化学兴趣小组在实验室做课外探究实验,如图所示,他们将一支烧杯罩在![]() 支燃着的高低不同的蜡烛上,发现总是高的蜡烛先灭,请你随他们一同探究。
支燃着的高低不同的蜡烛上,发现总是高的蜡烛先灭,请你随他们一同探究。
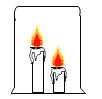
(提出问题)为什么高的蜡烛先灭?
(猜想假设)猜想1:高的先灭是因为_____ 猜想2:高的先灭是因为上部的氧气被消耗。
(实验验证1)为了验证猜想1是否正确,小明同学进行了如下实验。
步骤 | 现象 | 结论 |
将浸有澄清石灰水的滤纸分别放在烧杯的顶部和底部,在滤纸上滴加酚酞,变色后,用烧杯罩住点燃的高低蜡烛,观察高低滤纸褪色顺序(如图) | _____. | 烧杯上层二氧化碳浓度较高。高蜡烛先熄灭与二氧化碳浓度过高有关。涉及到的化学方程式:_____. |
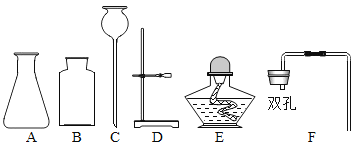
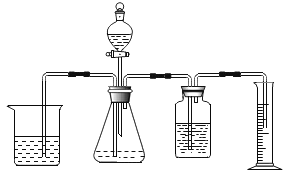
小红却对小明的结论表示怀疑,她用下面装置收集一瓶80%二氧化碳与![]() 氧气的混合气体,最右边仪器的名称叫_____;小红将燃着的蜡烛伸入收集的混合气体中,发现_____,从而证明小明的结论不正确。
氧气的混合气体,最右边仪器的名称叫_____;小红将燃着的蜡烛伸入收集的混合气体中,发现_____,从而证明小明的结论不正确。
(实验验证2)为了验证猜想2,小红利用手持技术试验,用氧气、二氧化碳传感器在烧杯顶部测量杯内两支蜡烛从点燃到全部熄灭后,杯内氧气和二氧化碳的浓度变化,如图所示。剩余氧气浓度![]() ,二氧化碳浓度
,二氧化碳浓度![]() 。二氧化碳浓度增大不多,而氧气浓度明显下降。
。二氧化碳浓度增大不多,而氧气浓度明显下降。

(实验结论)_____.
(反思评价)
附加分:若正确回答下列小题,将获得![]() 分的奖励,但化学试卷总分不超过
分的奖励,但化学试卷总分不超过![]() 分。
分。
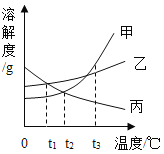
根据图中曲线(装置内氧气浓度)变化分析,在_____(填“![]() ”)点时蜡烛全部熄灭;请解释曲线
”)点时蜡烛全部熄灭;请解释曲线![]() 段、
段、![]() 段、
段、![]() 段变化原因。
段变化原因。
![]() 段:_____.
段:_____.
![]() 段:_____.
段:_____.
![]() 段:_____.
段:_____.