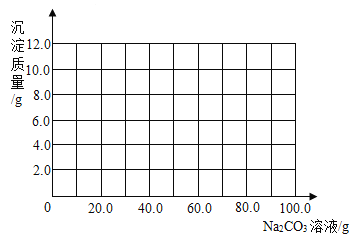
题目内容
【题目】以白云石(主要成分化学式为 MgCO3CaCO3)为原料制备氢氧化镁的工艺流程如下图(流程图方框中的文字均表示操作过程):
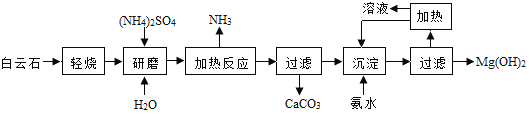
(1)白云石属于________物(选填“混合”“纯净”),白云石“轻烧”过程中只发生了碳酸镁的分解,写出碳酸镁分解反应的化学方程式________________。
(2)流程图中“加热反应”是指硫酸铵与氧化镁在加热条件下反应生成一种盐、氨气和水,其化学方程式为____________________; 流程图中“沉淀”过程是指氨水和硫酸镁发生复分解反应,其化学方程式为_________________; 硫酸铵中氮元素的化合价是_________价。
(3)该工艺中可以循环使用的物质是_______________、(NH4)2SO4 等.
(4)传统制备氢氧化镁的工艺是将白云石高温下分解为氧化镁和氧化钙后再提取,而本工艺流程采用轻烧白云石的方法,其优点是______________(填写一条,合理即可).
【答案】混合 ![]()
![]()
![]() ﹣3 NH3 减少能源消耗(或便于分离碳酸钙)
﹣3 NH3 减少能源消耗(或便于分离碳酸钙)
【解析】
(1)白云石主要成分化学式为 MgCO3CaCO3,还有其他杂质,属于混合物,白云石“轻烧”过程中只发生了碳酸镁的分解,碳酸镁分解生成氧化镁和二氧化碳,反应的化学方程式![]() 。
。
(2)流程图中“加热反应”是指硫酸铵与氧化镁在加热条件下反应生成一种盐、氨气和水,根据质量守恒定律可知,生成的盐是硫酸镁,反应化学方程式为![]() ;氨水和硫酸镁发生复分解反应,互相交换成分生成氢氧化镁和硫酸铵,反应的化学方程式为
;氨水和硫酸镁发生复分解反应,互相交换成分生成氢氧化镁和硫酸铵,反应的化学方程式为![]() ; 硫酸铵中硫酸根离子显-2价,氢元素显+1价,设氮元素的化合价为x,[x+(+1) ×4] ×2+(-2)=0,x=﹣3。
; 硫酸铵中硫酸根离子显-2价,氢元素显+1价,设氮元素的化合价为x,[x+(+1) ×4] ×2+(-2)=0,x=﹣3。
(3)根据流程图可知,加热硫酸铵与氧化镁生成氨气,沉淀过程中又用氨水和硫酸镁反应生成硫酸铵,故该工艺中可以循环使用的物质是NH3、(NH4)2SO4 等。
(4)将白云石高温下分解为氧化镁和氧化钙后再提取,消耗能源较多,根据流程图可知本工艺流程方便分离碳酸钙,故轻烧白云石的方法制备氢氧化铝的优点是:减少能源消耗,便于分离碳酸钙。

【题目】某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
(提出问题)氢氧化钠与盐酸是否发生了化学反应?
(查阅资料)酸与碱发生中和反应会放出热量.
(实验设计)甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
同学 | 实验操作 | 现象 | 结论 |
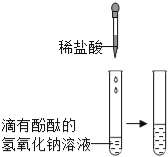
甲 |
| 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
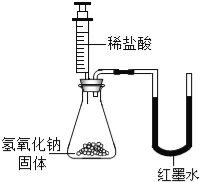
乙 |
| U型玻璃管中 边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
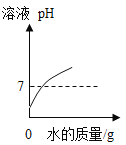
丙 | 用 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH | 最后溶液的pH (填“≥7”、“≤7”、“不变” | 氢氧化钠与盐酸发生了化学反应 |
(评价反思)你认为实验设计方案不合理的同学是 ,理由是 .
(拓展延伸)另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是 (填以下序号).
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳