题目内容
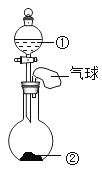
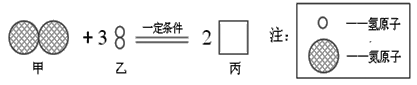
【题目】同学们做甲、乙两个中和反应实验的探究。
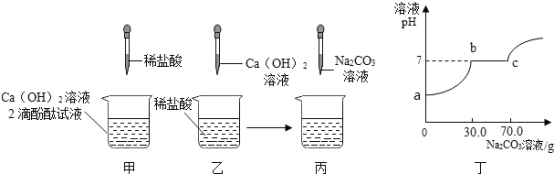
(1)甲实验恰好中和,则该溶液中的溶质是___________________(填化学式)。
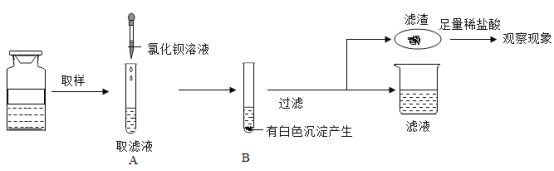
(2)取乙反应后的溶液![]() ,滴加质量分数为
,滴加质量分数为![]() 的
的![]() 溶液(见图丙),溶液
溶液(见图丙),溶液![]() 的变化如图3-4-7所示。则与
的变化如图3-4-7所示。则与![]() 反应的碳酸钠溶液的质量为__________
反应的碳酸钠溶液的质量为__________![]() ;请计算该溶液中
;请计算该溶液中![]() 的质量分数_________(写出计算过程,精确到
的质量分数_________(写出计算过程,精确到![]() )。
)。
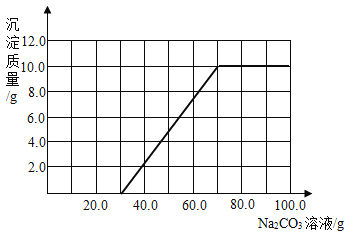
(3)根据计算所得数据在下图中画出产生沉淀的曲线_________。
(4)乙组的中和反应实验设计存在的不足是_______________
【答案】![]()
![]()
![]() 。
。  无法判断是否恰好反应
无法判断是否恰好反应
【解析】
(1)稀盐酸与![]() 溶液恰好完全中和,反应生成
溶液恰好完全中和,反应生成![]() 和
和![]() ,故溶液中的溶质是
,故溶液中的溶质是![]() 。
。
(2)从题图3-4-7中可知刚开始滴入的碳酸钠溶液先与乙中过量的盐酸反应,溶液的![]() 逐渐增大,当溶液的
逐渐增大,当溶液的![]() 刚达到
刚达到![]() 时,盐酸恰好全部反应完,此时消耗碳酸钠溶液
时,盐酸恰好全部反应完,此时消耗碳酸钠溶液![]() ;继续滴入碳酸钠溶液,碳酸钠再与
;继续滴入碳酸钠溶液,碳酸钠再与![]() 溶液反应,因反应生成
溶液反应,因反应生成![]() 沉淀和
沉淀和![]() ,溶液的
,溶液的![]() 保持不变,当
保持不变,当![]() 恰好完全反应时,此时消耗碳酸钠溶液的总质量为
恰好完全反应时,此时消耗碳酸钠溶液的总质量为![]() ;继续滴入碳酸钠溶液,因碳酸钠溶液呈碱性,溶液的
;继续滴入碳酸钠溶液,因碳酸钠溶液呈碱性,溶液的![]() 且
且![]() 逐渐增大。因此与
逐渐增大。因此与![]() 溶液反应的碳酸钠溶液的质量
溶液反应的碳酸钠溶液的质量![]() ,
,![]() 碳酸钠溶液中溶质的质量
碳酸钠溶液中溶质的质量![]() ,根据化学方程式,由碳酸钠的质量可求出
,根据化学方程式,由碳酸钠的质量可求出![]() 的质量,因所取乙溶液的质量为
的质量,因所取乙溶液的质量为![]() ,根据计算公式:溶质质量分数
,根据计算公式:溶质质量分数![]() ,可求出溶液中
,可求出溶液中![]() 的质量分数,
的质量分数,
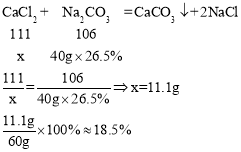
故该溶液中![]() 的质量分数是18.5%。
的质量分数是18.5%。
故填:40.0g;18.5%。
(3)当滴入碳酸钠溶液的质量为![]() 时,溶液开始产生沉淀;随着碳酸钠溶液的不断滴入,沉淀质量逐渐增多;当滴入的碳酸钠溶液的总质量为
时,溶液开始产生沉淀;随着碳酸钠溶液的不断滴入,沉淀质量逐渐增多;当滴入的碳酸钠溶液的总质量为![]() 是,沉淀达到最大量,可根据化学方程式
是,沉淀达到最大量,可根据化学方程式![]() ,由
,由![]() 碳酸钠可求出生成
碳酸钠可求出生成![]() 沉淀的最大量
沉淀的最大量![]() ;当
;当![]() 全部反应后,再继续滴入碳酸钠溶液,沉淀质量不再增加。根据沉淀质量随所滴入碳酸钠溶液质量的变化情况可画出曲线。
全部反应后,再继续滴入碳酸钠溶液,沉淀质量不再增加。根据沉淀质量随所滴入碳酸钠溶液质量的变化情况可画出曲线。

(4)乙中稀盐酸与![]() 溶液反应无明显现象,也未加指示剂,无法判断是否恰好反应。
溶液反应无明显现象,也未加指示剂,无法判断是否恰好反应。