题目内容
【题目】下列图像中有关量的变化趋势与选项要求相符合的是
A.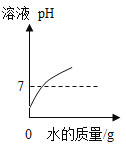 向硝酸溶液中不断加水
向硝酸溶液中不断加水
B. 过氧化氢分解生成氧气,一份加入二氧化锰,一份不加入二氧化锰
过氧化氢分解生成氧气,一份加入二氧化锰,一份不加入二氧化锰
C.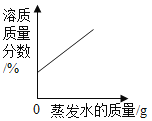 在恒温条件下,将饱和NaCl溶液蒸发适量水
在恒温条件下,将饱和NaCl溶液蒸发适量水
D.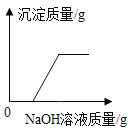 向一定量的稀硫酸和硫酸铜的混合溶液中滴入氢氧化钠溶液至过量
向一定量的稀硫酸和硫酸铜的混合溶液中滴入氢氧化钠溶液至过量
【答案】D
【解析】
A、向硝酸溶液中不断加水,溶液的pH会变大,但是不会等于和大于7,图像错误;
B、过氧化氢分解生成氧气,加入二氧化锰不会改变生成氧气的质量,即两份生成氧气质量相等,图像错误;
C、在恒温条件下,将饱和NaCl溶液蒸发适量水,会析出晶体,但溶液仍然是该温度下的饱和溶液,溶质质量分数不改变,图像错误;
D、硫酸铜和氢氧化钠溶液反应生成氢氧化铜沉淀,但是氢氧化铜沉淀和稀硫酸反应生成硫酸铜和水,故氢氧化钠先和稀硫酸反应生成硫酸钠和水,后和硫酸铜反应生成沉淀,图像正确。
故选D。

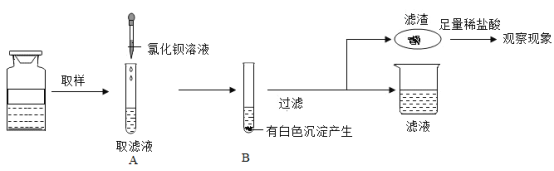
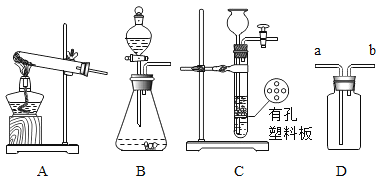
【题目】某化学实验小组对 “影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
[进行实验]室温下,选用20mL不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________________。
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是____。

开始实验时,应将20mL稀盐酸_____________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
[处理数据](3)实验小组进行实验后,获得的相关实验数据如表所示:
实验 编号 | 盐酸的溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳的体积/mL (均收集前30s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是_______(写一组),由此可得到的结论是_______________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_____________。
(4)如表是实验时记录生成的二氧化碳气体的体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 | |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变____,其主要原因是___。
(5)你认为影响石灰石与盐酸反应速率的因素还有____,请设计实验方案验证你的猜想:____
【题目】李婉仪同学在做 NaOH 溶液与 CuSO4 溶液反应的实验时,观察到有蓝色沉淀生成,对该沉淀进行加热,一般会看到蓝色沉淀变成黑色,可有时却看到蓝色沉淀变成绿色。李同学对此异常现象产生了兴趣,决定对此现象产生的实验条件进行探究。
(查阅资料)难溶性碱受热易分解成对应的金属氧化物。写出上述生成蓝色沉淀以及蓝色沉淀变成黑色的化学反应方程 ________________、______________。
(提出问题)加热蓝色沉淀产生黑色固体与什么因素有关?
(作出猜想)猜想 1:与 CuSO4 溶液过量有关;猜想 2:与 NaOH 溶液过量有关。
(设计实验)限选试剂:1%NaOH 溶液,20%NaOH 溶液,1%CuSO4 溶液,20%CuSO4 溶液。
实验方案 | 实验现象 | 实验结论 |
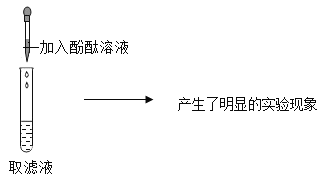
(1)向 2 mL 20%CuSO4 溶液中滴加 2 滴 1%NaOH 溶液,再将所得沉淀加热 | 先产生蓝色沉淀,加热后___________。 | 猜想 1 成立 |
(2)_______________,再将所得沉淀加热 | 先产生蓝色沉淀,加热后___________。 | 猜想 2 不成立 |
(得到结论)在上述实验中,要能观察到蓝色沉淀变成黑色,关键是________。
(拓展与思考)进一步查阅资料得知,上述绿色物质是溶解度比氢氧化铜更小的水胆矾[化学式为Cu4(OH)6SO4],该物质能与酸反应,形成蓝色溶液。李同学想设计一个实验,证明该绿色物质中含有硫酸根,于是将上述绿色物质用蒸馏水洗涤、烘干,再溶解在足量的溶液 A 中,向所得溶液中滴加溶液 B,若有白色沉淀生成,则表示原绿色物质中有硫酸根。试推测:溶液 A 中溶质的化学式是______,溶液 B 中溶质的化学式是___________。
【题目】请回忆你和老师共同学习的酸和碱反应的实验探究,并按要求进行实验设计与
(实验探究)
(1)据图设计酸和碱反应:

实验步骤 | 实验现象 | 结论 |
①向烧杯中加入 10mL 氢氧化钠溶液,并滴入几滴酚酞试液 | ①溶液颜色_____; | 酸和碱发生了中和反应。 |
②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液 | ②不断搅拌溶液至溶液颜色变成_____色 |
写出硫酸与氢氧化钠反应的化学方程式__________________。
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙两位同学设计了以下方案:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
甲同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
乙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
(实验评价)
①甲、乙两位同学设计的二个方案中,有一个正确的方案,是________(填“甲”“乙” )。
②请分析另一个同学方案错误的原因是__________。
(实验反思)
探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂是(__________)
AFe BCa(OH)2 CCuO DNa2CO3