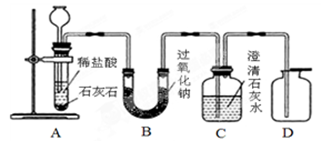
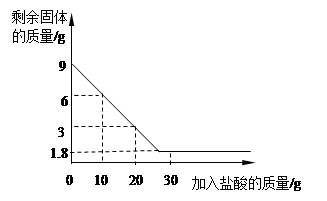题目内容
某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图)。疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H20 2NaAl02+3H2↑。请回答下列有关问题:
(1)该管道疏通剂需要密封保存的原因是 。
(2)按照使用说明,该同学对“疏通剂”作了进一步研究。
先向烧杯中加人206g水,再加入本品200g,当铝粉
全部反应后,求:(计算结果保留1位小数)
①生成氢气的体积。(ρ氢气一0.09g/L)
②反应后溶液中氢氧化钠的质量分数。
(1)易潮解,吸水易变质
(2)66.7L ,16.5%
解析试题分析:(1)由于疏通剂的主要成分是氢氧化钠固体,氢氧化钠固体易吸水发生潮解故要密封保存;
(2)200g疏通剂中含有铝的质量为54g,利用化学方程式铝与氢气的质量比即可计算出氢气的质量和参加反应的氢氧化钠的质量,氢气的质量除以密度即为氢气的体积;
设生成氢气的质量为y,参加反应的氢氧化钠的质量为x;
2Al+2NaOH+2H20 2NaAl02+3H2↑
54 80 6
54g x y
54/80 =54g/x 54/6 =54g/y
X=80g y=6g
氢气的体积=6g÷0.09g/L=)66.7L
反应后溶液中氢氧化钠的质量=200g-54g-80g=66g
反应后溶液的质量=206g+200g-6g=400g
反应后溶液中氢氧化钠的质量分数=66g/400g ×100%=16.5%
答:略
考点:根据化学方程式的计算、溶质质量分数的计算

小红同学在网店花了200元买了一个10g重的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究:在实验室用足量的稀硫酸分多次与手镯充分反应,实验结果如下表:
| 稀硫酸/g | 10 | 10 | 10 | 10 | 10 |
| 剩余固体质量/g | 8.7 | 7.4 | 6.1 | 4.8 | 4.8 |
(1)如果小红用所得的银制作一枚戒指,其质量不超过多少克?
(2)计算所用稀硫酸的溶质质量分数是多少?