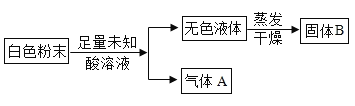
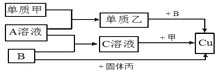
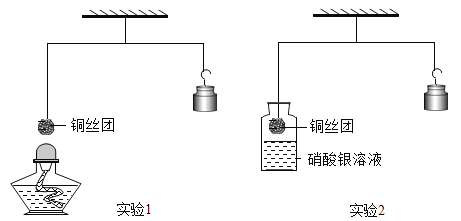
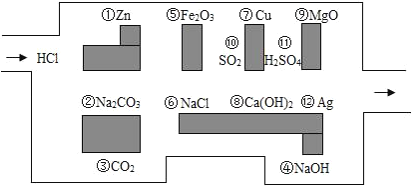
题目内容
【题目】现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4═CuSO4+H2O)试回答下列问题:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
(1)上述表格中m的值为_____,10g样品中CuO的质量为______g.
(2)计算所加入稀硫酸中溶质的质量分数_______?
(3)计算最后所得溶液中硫酸铜的质量分数_________(精确到0.1%)
【答案】3 7 12.25% 13.1%
【解析】
(1)由表可知,每20g的稀硫酸可以反应2g的氧化铜,说明第四次实验中氧化铜已经完全反应,故m=3g。样品中氧化铜的质量为:10g-3g=7g。
(2)设20g的稀硫酸中溶质的质量分数为x,以第一次实验数据为准;
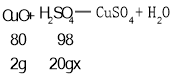
![]() 解得x=12.25%
解得x=12.25%
(3)设7g的氧化铜反应生成硫酸铜的质量为y
![]()
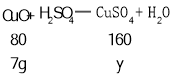
![]() 解得y=14g。
解得y=14g。
故反应后溶液中硫酸铜的质量分数为:![]() ×100%≈13.1%。
×100%≈13.1%。

练习册系列答案
相关题目